Moléculas orgânicas polares e apolares
A polaridade das moléculas orgânicas é definida pela diferença de eletronegatividade que se estabelece entre os átomos dos elementos químicos. Eletronegatividade é a capacidade que um átomo tem de atrair para si o par eletrônico que ele compartilha com outro átomo em uma ligação covalente.
Todas as ligações dos compostos orgânicos são covalentes, assim, se houver diferença de eletronegatividade na molécula, ocorrendo um deslocamento de carga, ela será polar; mas se não houver diferença de eletronegatividade entre os átomos, a molécula será apolar.
As ligações mais frequentes envolvendo os compostos orgânicos acontecem entre átomos de carbono ou entre átomos de carbono e hidrogênio, isto é, hidrocarbonetos. O carbono é tetravalente, ou seja, ele faz quatro ligações, que podem ser estabelecidas por meio de ligações simples, duplas ou triplas.
Qualquer um desses tipos de ligações será apolar se for entre átomos de carbono ou entre carbonos e hidrogênios, em que não há praticamente diferença de eletronegatividade. Consequentemente, se a molécula for formada apenas por esses tipos de ligações, ela também será apolar. Veja os exemplos abaixo:
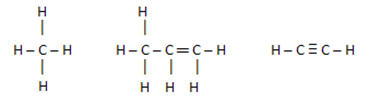
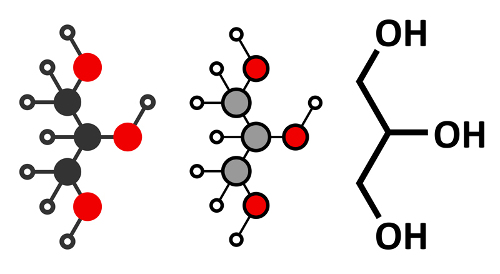
No entanto, as moléculas pertencentes a outras funções orgânicas, diferentes dos hidrocarbonetos, possuem outros tipos de átomos ligados a átomos de carbono e/ou a átomos de hidrogênio. Por exemplo, os grupos funcionais dos álcoois, cetonas, ésteres, aldeídos, ácidos carboxílicos e éteres possuem o elemento oxigênio; as amidas, as aminas e os nitrocompostos possuem o elemento nitrogênio, os haletos orgânicos possuem halogênios, que podem ser o flúor, cloro, bromo e iodo, e os tiocompostos possuem o enxofre.
Todos esses elementos mencionados (O, N, F. Cl. Br, I e S) são mais eletronegativos que o carbono, por isso, a presença deles nas moléculas orgânicas provoca o aparecimento de uma região com acúmulo de carga elétrica. Isso significa que se a molécula possuir mesmo que seja apenas um átomo diferente do carbono e do hidrogênio, ela será polar.
Exemplos de moléculas polares:
OBS.: Vale ressaltar que existem casos de moléculas organicas como o tetracloreto de carbono (CCl4), que apresenta elemento químico muito eletronegativo, porém a molécula é apolar.
Mesmo que em sua estrutura contenha uma parte apolar, se a molécula tiver uma região polar, ela será considerada polar.
A polaridade das moléculas orgânicas afeta suas propriedades químicas e físicas. Para citar um exemplo, consideremos a solubilidade dos compostos orgânicos.
As moléculas apolares são praticamente insolúveis em água, pois ela é polar, mas esses compostos tendem a se dissolver em outros compostos orgânicos. A graxa, por exemplo, é um composto orgânico apolar, por isso não conseguimos limpar nossa pele suja de graxa usando água, mas é necessário usar um solvente orgânico apolar, como a gasolina.
Por outro lado, os compostos orgânicos polares são solúveis em água, como é o caso do álcool, ácido acético (vinagre comum), da acetona, do açúcar, entre outros.



