Segundo Princípio da Termodinâmica
Como se sabe, o calor pode ser convertido em trabalho, mas segundo o físico francês Sadi Carnot, há restrições para que isto ocorra. Carnot foi, além de físico, matemático e engenheiro que e obteve grande sucesso ao fazer os primeiros ensaios sobre as máquinas térmicas, como também ao apresentar os fundamentos da segunda lei da termodinâmica.
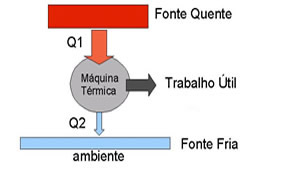
Segundo esse famoso físico, para que haja contínua conversão de calor em trabalho, um sistema como, por exemplo, uma máquina térmica, deve realizar ciclos contínuos entre uma fonte quente e uma fonte fria, as quais devem permanecer com temperaturas constantes. A cada ciclo, o sistema retira uma quantidade de calor da fonte quente. Parte desse calor é convertido em trabalho e o restante é rejeitado para a fonte fria. Por exemplo: em um automóvel a fonte quente é o motor, local onde ocorre a queima do combustível. Dessa fonte é retirada, a cada ciclo, uma quantidade de calor. Parte deste é convertida em trabalho mecânico, fazendo o automóvel se movimentar, é chamada energia útil. A outra parte do calor que não é aproveitada é rejeitada para a atmosfera, fonte fria, por meio do escapamento.
Toda máquina térmica tem um rendimento e este pode ser calculado através da relação entre o trabalho realizado pela máquina, energia útil, e a quantidade de calor que foi retirada da fonte quente, energia total, matematicamente temos:
r = T/ Q1
Onde T é o trabalho realizado pela máquina e Q1 é a quantidade de calor retirada da fonte quente. O ideal seria que as máquinas térmicas tivessem 100% de rendimento, mas na prática isso não acontece. Na realidade, as máquinas possuem rendimento muito inferior a esse valor, por exemplo: os motores à gasolina possuem rendimento que não ultrapassa os 30%; já os motores a diesel são mais eficientes, o rendimento chega próximo dos 40% e as locomotivas a vapor têm rendimento de aproximadamente 10%.