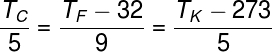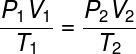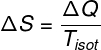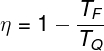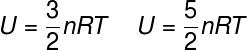Termodinâmica
A termodinâmica é o estudo das leis que regem as relações entre calor, trabalho e temperatura, bem como as transformações sofridas pela energia. A termodinâmica estuda o intercâmbio de energia entre sistemas macroscópicos, formados por um grande número de partículas, como os gases, fluidos e sólidos, recorrendo à análise de importantes grandezas físicas, como pressão, volume e temperatura.
Introdução à termodinâmica
Uma das ideias centrais da termodinâmica é a relação entre calor e trabalho mecânico: a partir dessa relação foi possível que construíssemos máquinas térmicas cada vez mais eficientes e úteis, como a máquina a vapor e os motores de combustão interna. Para que se entenda o funcionamento desses sistemas mais complexos, é necessário aprender alguns conceitos imprescindíveis para a compreensão da termodinâmica, por isso, vamos revisar cada um desses conceitos de forma detalhada, a seguir.
Veja também: Ciclo de Carnot e o funcionamento das máquinas térmicas
Conceitos da Termodinâmica
Conheça alguns dos mais importantes conceitos da termodinâmica:
-
Sistema termodinâmico
Sistema termodinâmico é um conceito abstrato que pode ser entendido como uma região do espaço, ou ainda uma certa porção de matéria que possa ter suas grandezas termodinâmicas, como pressão, volume e temperatura, medidas.
No âmbito da termodinâmica, existem dois tipos de sistemas: abertos e fechados. Nos sistemas abertos, há transferência de matéria para além da fronteira que separa um sistema de suas vizinhanças; já nos sistemas fechados, a quantidade inicial de matéria mantém-se constante após quaisquer que sejam as transformações feitas sobre ele.

-
Estado termodinâmico
O estado termodinâmico de um sistema é definido por um conjunto de grandezas que devem ser especificadas para que as condições desse sistema possam ser reproduzidas. Os estados termodinâmicos são representados por funções que são válidas para quando o sistema se encontra em equilíbrio térmico, mecânico e químico, explicados adiante.
Para os sistemas termodinâmicos simples, como os que são estudados no âmbito do ensino médio, essas funções geralmente relacionam duas propriedades intensivas da matéria, como pressão e temperatura. Quando algum sistema deixa um estado termodinâmico, assumindo um novo estado, dizemos que esse sistema passou por um processo termodinâmico.
-
Equilíbrio termodinâmico
O equilíbrio termodinâmico é a condição em que dois ou mais sistemas não realizam trocas de energia ou massa entre si, portanto, passado um longo tempo, sob tais condições, será impossível que se meça quaisquer mudanças macroscópicas nas variáveis de estado (pressão, volume e temperatura) desses sistemas.
Como explicado anteriormente, para que o equilíbrio termodinâmico seja atingido, é necessário que os sistemas encontrem-se em equilíbrio mecânico, químico e térmico, ou seja, é preciso que, sobre esses sistemas não atuem quaisquer forças resultantes externas, que entre as fronteiras do sistema ocorram quaisquer tipos de reações químicas e finalmente, que não haja diferença de temperatura entre dois pontos quaisquer situados no interior do sistema. Se quiser entender mais sobre o conceito, acesse o nosso texto sobre equilíbrio térmico.
-
Temperatura
A temperatura é a expressão macroscópica do movimento oscilatório de todas as partículas que compõem um sistema termodinâmico. Em outras palavras, entendemos a temperatura como a energia cinética média translacional, rotacional e vibracional dos átomos e moléculas que constituem um corpo: quanto maior for a velocidade dessas partículas, maior será a temperatura do corpo.
A temperatura é medida em diferentes escalas, como a escala celsius e a escala kelvin. Essa última é usada como a definição formal de temperatura, de acordo com o Sistema Internacional de Unidades: 1 kelvin equivale à fração de 1/273,16 vezes a temperatura do ponto triplo da água pura, no entanto, sua definição é mais profunda, diz respeito ao estado de movimento dos átomos.
A temperatura de 0K, por exemplo, conhecida como zero absoluto, é o limite hipotético de temperatura, no qual todos os átomos de um corpo encontram-se em repouso. Quer aprender mais sobre o assunto? Acesse o nosso texto sobre temperatura.
-
Calor
Calor é a troca de energia entre sistemas termodinâmicos que é motivada exclusivamente em razão de uma diferença de temperatura. O calor pode ser medido em calorias, ou em joules. A caloria, por sua vez, é definida como a quantidade de energia que deve ser cedida à massa de 1g de água para que a sua temperatura varie em 1 ºC (entre 14,5ºC e 15,5ºC), sob uma pressão externa e constante de 1 atm.
O calor pode ser transferido de diversas maneiras entre os corpos, os processos mais comuns de transferência de calor são conhecidos como condução, convecção e irradiação. Para saber mais sobre esse conceito, acesse o nosso texto: calor.
-
Energia interna
Energia interna é a soma das energias cinéticas de cada partícula de um corpo. No contexto do ensino médio, muito frequentemente utiliza-se o termo energia térmica como um sinônimo de energia interna, no entanto, tratam-se de coisas um pouco diferentes. A energia interna está intimamente relacionada à temperatura média do corpo, que por sua vez, está relacionada com o grau de agitação molecular.
Fórmulas da termodinâmica
A termodinâmica é uma grande área da física e, por isso, vem acompanhada de um enorme número de fórmulas. Nessa seção, traremos somente as principais fórmulas utilizadas durante o estudo da termodinâmica, confira na tabela a seguir:
|
Fórmula
|
Descrição
|
|
Calor sensível
|
A equação fundamental da calorimetria é usada para determinar a quantidade de calor transferida por um corpo, em razão de uma mudança de temperatura.
|
|
Calor latente
|
A fórmula de calor latente, por sua vez, mede a quantidade de calor necessária para que uma mudança de estado físico ocorra. |
|
Conversão de temperaturas
|
As três fórmulas ao lado são usadas para converter as temperaturas escritas nas escalas celsius, fahrenheit e kelvin, respectivamente. |
|
Equação de Clapeyron
|
A equação de Clapeyron deriva da lei geral dos gases. Ela relaciona pressão, volume e temperatura com o número de mols de um gás ideal. |
|
Lei geral dos gases
|
A lei geral dos gases afirma que o produto entre pressão e volume, dividido pela temperatura termodinâmica do gás ideal é sempre constante. |
|
Primeira lei da termodinâmica
|
De acordo com a primeira lei da termodinâmica, a variação da energia equivale à diferença entre a quantidade de calor e o trabalho termodinâmico.
|
|
Entropia
|
A variação de entropia é calculada pela razão entre a quantidade de calor transferida e a temperatura da transformação isotérmica. |
|
Rendimento da máquina de Carnot
|
O rendimento de uma máquina de Carnot depende exclusivamente das temperaturas em que operam as fontes quente e fria. |
|
Trabalho termodinâmico na transformação isobárica
|
Na transformação isobárica, o trabalho realizado ou recebido pode ser calculado pelo produto entre a pressão e a variação de volume. |
|
Energia interna do gás monoatômico ideal e do gás diatômico
|
A energia interna dos gases moleculares monoatômicos e diatômicos é calculada pelas fórmulas ao lado, em que n é o número de mols. |
Leis da termodinâmica
As leis da termodinâmica descrevem o comportamento de diversos sistemas e a forma como se dão as trocas de energia com suas vizinhanças, vamos conhecer melhor cada uma delas:
-
Lei zero da termodinâmica
A lei zero da termodinâmica, também conhecida como Lei do equilíbrio térmico, afirma que, se dois ou mais corpos permanecerem em contato térmico por um longo intervalo tempo, suas temperaturas tenderão a se igualar. Para que isso ocorra, o corpo de maior temperatura emite calor em direção ao corpo de menor temperatura. Saiba mais sobre o assunto acessando o nosso texto sobre a lei zero da termodinâmica.
-
Primeira lei da termodinâmica
A primeira lei de termodinâmica, conhecida como lei da conservação da energia, afirma que, toda a quantidade de calor transferido de, ou para um sistema termodinâmico pode resultar em uma variação de energia interna e/ou na realização de trabalho. A fórmula utilizada para o cálculo da Primeira lei da termodinâmica é mostrado abaixo:
![]()
ΔU – variação de energia interna
Q – calor
τ - trabalho
-
Segunda lei da termodinâmica
A segunda lei da termodinâmica é relacionada a uma grandeza física conhecida como entropia. De acordo com essa lei, qualquer processo termodinâmico irreversível e espontâneo causa um aumento na entropia de um sistema, tornando-o menos organizado. A seguir, trazemos a fórmula que é utilizada para o cálculo da variação de entropia de um sistema, observe:
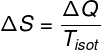
ΔS – variação de entropia
ΔQ – transferência de calor
TISOT – temperatura isotérmica
Caso queira saber mais sobre a segunda lei da termodinâmica, sugerimos que confira nosso texto sobre entropia.
-
Terceira lei da termodinâmica
A terceira lei da termodinâmica indica que o zero absoluto, cerca de -273,15 ºC é inalcançável. De acordo com essa lei, não é possível que nada atinja tal temperatura, uma vez que, teoricamente, nessa temperatura, os átomos se encontrariam perfeitamente parados, algo que violaria o princípio da incerteza, fundamentado na mecânica quântica.
Leia também: Conheça algumas incríveis curiosidades da física quântica
Exercícios resolvidos sobre Termodinâmica
Questão 1) (Uece) Do ponto de vista da primeira lei da termodinâmica, o balanço de energia de um dado sistema é dado em termos de três grandezas:
a) trabalho, calor e densidade
b) trabalho, calor e energia interna
c) calor, energia interna e volume
d) pressão, volume e temperatura
Gabarito: Letra B
Resolução:
De acordo com a primeira lei da termodinâmica, o balanço de energias é determinado pela relação entre energia interna, calor e trabalho, como mostramos na fórmula abaixo:
![]()
Portanto, a alternativa correta é a letra B.
Questão 2) (FGV - RJ) Ao realizar um trabalho de 80 mil calorias, um sistema termodinâmico recebeu 60 mil calorias.
Pode-se afirmar que, nesse processo, a energia interna desse sistema
a) aumentou 20 mil calorias.
b) diminuiu 20 mil calorias.
c) aumentou 60 mil calorias.
d) diminuiu 80 mil calorias.
e) se conservou.
Gabarito: Letra A
Resolução:
De acordo com os dados do enunciado e por meio da primeira lei da termodinâmica, basta fazermos o seguinte cálculo:
![]()
Como o trabalho foi realizado pelo próprio gás, seu sinal será positivo, dessa maneira, prevalece o sinal negativo da fórmula, resultando em -20.000 cal. Portanto, a alternativa correta é a letra A.
Questão 3) (Uem) Assinale o que for correto:
01) A energia interna total permanece constante em um sistema termodinâmico isolado.
02) Quando um sistema termodinâmico recebe calor, a variação na quantidade de calor que este possui é positiva.
04) O trabalho é positivo, quando é realizado por um agente externo sobre o sistema termodinâmico, e negativo, quando é realizado pelo próprio sistema.
08) Não ocorre troca de calor entre o sistema termodinâmico e o meio, em uma transformação adiabática.
16) Não ocorre variação da energia interna de um sistema termodinâmico, em uma transformação isotérmica.
Gabarito: 27
Resolução: (01+08+16 = 27)
01 – VERDADEIRO - Nesse tipo de sistemas, não há variação de temperatura, uma vez que não há trocas de calor.
02 – VERDADEIRO – O sinal algébrico do calor é positivo quando é o gás quem o recebe.
04 – FALSO – O trabalho é positivo quando é realizado pelo gás.
08 – VERDADEIRO – Não há trocas de calor nas transformações adiabáticas.
16 – VERDADEIRO – Transformações isotérmicas são aquelas em que não há trocas de calor.