Balanceamento de Equações Químicas
A Lei de Conservação das Massas descoberta por Lavoisier é muito conhecida, ela diz: "Na natureza nada se cria e nada se perde, tudo se transforma".
Essa lei nos mostra que quando ocorrem reações químicas a massa se conserva porque não ocorrem criação nem destruição dos átomos, eles apenas se rearranjam para formar novas substâncias. Os átomos permanecem inalterados, porém os agregados atômicos dos reagentes são desfeitos e novos agregados atômicos são formados, originando os produtos.
Portanto, a quantidade de átomos de cada elemento em uma equação química que representa uma reação deve ser a mesma nos reagentes (1º membro) e nos produtos (2º membro). Essa igualdade é obtida por meio do balanceamento dos coeficientes da equação. *

Existem vários métodos utilizados para realizar o balanceamento de uma equação, mas o mais utilizado é o método das tentativas, que é baseado nos seguintes princípios:
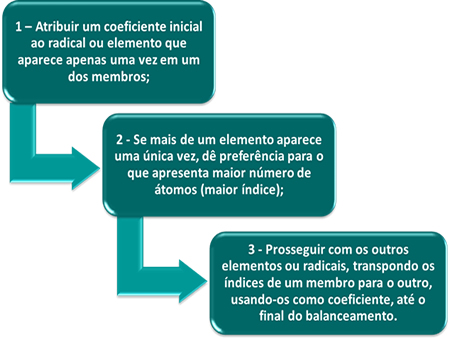
Veja a seguinte reação:
FeS2(g) + O2(g) → Fe2O3(s) + SO2(g)
Observe que o único elemento que não podemos começar o balanceamento é o oxigênio, pois ele aparece mais de uma vez no segundo membro. Podemos começar ou pelo ferro ou pelo enxofre. Seguindo a segunda regra, o ferro do 2º membro possui índice igual a 2, que é o maior, por isso, vamos começar por ele, colocando o índice 1 na substância Fe2O3(s):
FeS2(g) + O2(g) → 1 Fe2O3(s) + SO2(g)
Note que há dois átomos de ferro no 2º membro. Logo, deve haver o mesmo número desse elemento no lado esquerdo:
2 FeS2(g) + O2(g) → 1 Fe2O3(s) + SO2(g)
Agora sabemos também que existem 4 átomos de enxofre (S) do lado esquerdo da equação (lembre-se de que é preciso multiplicar o índice pelo coeficiente para saber quantos átomos existem), então esse será o coeficiente desse elemento no lado direito:
2 FeS2(g) + O2(g) → 1 Fe2O3(s) + 4 SO2(g)
Agora só falta acertar o oxigênio. Veja que no 2º membro temos um total de 11 átomos de oxigênio (1 . 3 + 4 . 2 = 11). No 1º membro, existem dois átomos de oxigênio, então seu índice será a fração (11/2):
2 FeS2(g) + 11/2 O2(g) → 1 Fe2O3(s) + 4 SO2(g)
A reação dessa forma está balanceada. Porém, é importante notar que os coeficientes são necessariamente os números inteiros menores possíveis. Portanto, é preciso eliminar a fração 11/2 sem acabar com a proporção estequiométrica. Podemos fazer isso ao multiplicar todos os coeficiente por 2 e dessa forma teremos a equação química devidamente balanceada:
4 FeS2(g) + 11 O2(g) → 2 Fe2O3(s) + 8 SO2(g)
Para ver se ficou correto, basta verificar se a quantidade de cada elemento nos dois membros está igual:
4 FeS2(g) + 11 O2(g) → 2 Fe2O3(s) + 8 SO2(g)
REAGENTES: PRODUTOS:
Fe = 4 . 1 = 4 átomos Fe = 2 . 2 = 4 átomos
S = 4 . 2 = 8 átomos S = 8 . 1 = 8 átomos
O = 11 . 2 =22 átomos O = (2 . 3) + (8 . 2) = 22 átomos
* Para tirar qualquer dúvida sobre os símbolos qualitativos e quantitativos de uma equação química, leia os textos: “Equações Químicas”, “Reações Químicas” e “Entendendo as Equações Químicas”.

