Número atômico e número de massa
O número atômico e o número de massa são dois parâmetros importantes informados pelo núcleo do átomo. O número atômico (Z) corresponde ao número de prótons no núcleo do átomo. O número de massa (A) corresponde ao número de partículas pesadas no núcleo atômico, ou seja, prótons e nêutrons. O número de massa pode ser calculado, então, pela fórmula A = Z + n, em que “n” corresponde ao número de nêutrons.
O número atômico é coletado da Tabela Periódica, pois ele serve para identificar os elementos químicos. Quando representamos elementos químicos em textos, deve-se representar o número atômico colocando o seu valor abaixo e à esquerda do símbolo do elemento químico, enquanto o número de massa deve ser escrito acima e à esquerda do elemento químico.
Leia também: Afinal, o que é um átomo?
Resumo sobre número atômico e número de massa
- O número atômico, representado pela letra Z, corresponde ao número de prótons no núcleo.
- O número de massa, representado pela letra A, corresponde ao somatório de partículas pesadas do núcleo: prótons e nêutrons.
- A fórmula geral para cálculo do número de massa é A = Z + n.
- O número atômico pode ser coletado na Tabela Periódica, enquanto o número de massa deve ser calculado.
- Quando representamos elementos químicos, o número atômico fica localizado embaixo e à esquerda do símbolo, enquanto o número de massa fica localizado em cima e à direita do símbolo.
O que é número atômico?
O número atômico, representado pela letra Z, é definido como o número de prótons que um átomo tem em seu núcleo. É usado para diferenciar os elementos químicos e para organizar os elementos na Tabela Periódica. Foi proposto, em 1913, pelo físico amador holandês Antonius van den Broek e mais bem explicado, fisicamente, pelo físico inglês Henry Moseley. Para saber mais sobre o número atômico, clique aqui.
O que é número de massa?
O número de massa, representado pela letra A, é definido como o número total de partículas pesadas (prótons e nêutrons) que um átomo tem em seu núcleo. Como a junção de prótons e nêutrons é conhecida como “núcleons”, alguns autores também podem se referir a esse número como “número de núcleon”.
Veja também: Qual a diferença entre número de massa e massa atômica?
Diferenças entre o número atômico e o número de massa
O número atômico faz referência apenas à quantidade de cargas presentes no núcleo atômico, ou seja, ele pode ser entendido como a carga nuclear da espécie atômica. Assim sendo, o número atômico depende unica e exclusivamente do número de prótons.
Já o número de massa é uma forma de se representar a massa da espécie atômica em termos das partículas que têm massa significativa na estrutura atômica: prótons e nêutrons. Os elétrons não são contabilizados, mesmo fazendo parte da estrutura básica do átomo, pois têm uma massa muito menor que a dos núcleons.
Como calcular o número atômico e o número de massa
O número atômico, em si, não precisa ser calculado. Ele é determinado apenas como o número prótons contidos no núcleo e pode ser encontrado na Tabela Periódica. Assim sendo, podemos dizer que:
Z = nº prótons
Como consequência de o átomo ser eletricamente neutro, o número de prótons é igual ao número de elétrons. Contudo, com a existência dos íons, não é possível dizer que o número atômico é também o número de elétrons, visto que uma espécie atômica pode ganhar ou perder elétrons.
Já o número de massa poderá ser calculado pelo somatório de partículas nucleares, ou seja, o somatório entre o número de prótons e nêutrons:
A = p + n
Em que “p” é o número de prótons e “n” é o número de nêutrons. Analogamente, como o número de prótons é o número atômico, a fórmula pode ser reescrita da seguinte forma:
A = Z + n
Em que Z é o número atômico.
Como identificar o número atômico e o número de massa
O número atômico pode ser encontrado na Tabela Periódica. O número atômico é, inclusive, a forma utilizada para dispor os elementos na tabela, que organiza os elementos em ordem crescente de número atômico.
O número de massa, entretanto, varia de isótopo para isótopo. Assim sendo, a Tabela Periódica não apresenta esse parâmetro, mas sim uma média ponderada dos números de massa dos isótopos dos elementos. O número de massa, aliás, é numericamente igual à massa atômica.
Contudo, quando escrevemos um elemento químico, é possível representar ambos os parâmetros: o número atômico deve ser colocado abaixo e à esquerda do símbolo do elemento, enquanto o número de massa deve ser posto em cima e à esquerda do símbolo do elemento.
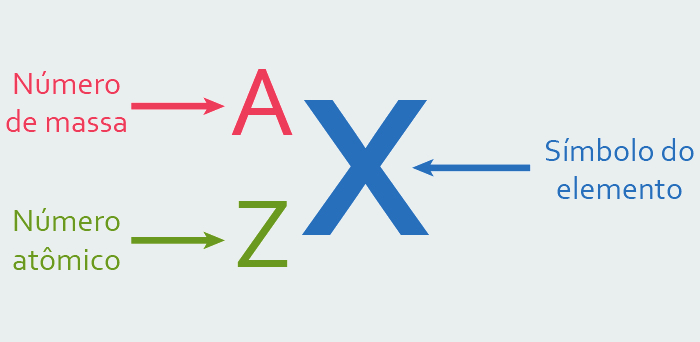
Por extensão, também é possível perceber o número de massa da espécie. Quando escrevemos, por exemplo, césio-137 ou Cs-137, estamos nos referindo ao isótopo de césio que tem número de massa igual a 137.
Saiba mais: Isótopos, isóbaros, isótonos e isoeletrônicos – conceitos e diferenças
Exercícios resolvidos sobre número atômico e número de massa
Questão 1. (Unesp/2024.1) O exame de diagnóstico por imagem denominado PET-Scan (sigla em inglês para Tomografia por Emissão de Pósitrons) utiliza como emissor de pósitrons (\(_{+1}^{0}e \)) o radionuclídeo 18F. Ao emitir um pósitron, esse radionuclídeo transforma-se no isótopo 18O, cujo número de prótons e número de nêutrons são, respectivamente, iguais a
(A) 8 e 10.
(B) 9 e 10.
(C) 8 e 9.
(D) 10 e 8.
(E) 10 e 9.
Resposta: Letra A
O isótopo 18O consiste no átomo de oxigênio com número de massa igual a 18 (o número está acima e à esquerda do símbolo). Ao se consultar a Tabela Periódica, vê-se que o elemento químico oxigênio tem Z = 8; assim, seu número de prótons é igual a 8.
O número de nêutrons é determinado assim:
A = Z + n
18 = 8 + n
n = 10
Ou seja, a espécie tem 10 nêutrons.
Questão 2. (Etec/2023.1) O iodo é um elemento químico que apresenta número de massa 127 e número atômico 53.
Na Química, pode ser representado da seguinte maneira: \(_{53}^{127}I \).
A partir das informações dadas para o elemento iodo, pode-se afirmar, corretamente, que apresenta
(A) 53 prótons.
(B) 53 nêutrons.
(C) 74 elétrons.
(D) 74 prótons.
(E) 127 nêutrons.
Resposta: Letra A
Ao ter número atômico 53, o iodo apresenta também 53 prótons. Todo átomo é eletricamente neutro, assim sendo, o iodo apresenta também 53 elétrons. O número de nêutrons é calculado da seguinte forma:
A = Z + n
127 = 53 + n
n = 74
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: https://goldbook.iupac.org/
TAVARES, O. A. P. Talento de Moseley: desvendando os segredos do átomo. Ciência e Sociedade – Centro Brasileiro de Pesquisas Físicas. v. 1, n. 1, 2013.