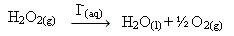Catálise Homogênea
Catálise é o processo no qual se usa uma substância com propriedades de acelerar a velocidade de determinadas reações sem ser consumida durante o processo. Esses compostos que diminuem a energia de ativação da reação, possibilitando que ela ocorra mais rapidamente e que são reconstituídos no final, são denominados catalisadores.
Como as reações de catálise são muito comuns na indústria e no nosso dia a dia, incluindo no nosso organismo e no meio ambiente, existem vários tipos de catálises. Temos, por exemplo, a catálise homogênea, a catálise heterogênea e a autocatálise.
Consideremos, então, apenas a catálise homogênea:

Um exemplo de ação catalítica homogênea ocorre na reação entre o dióxido de enxofre com o oxigênio para a formação do produto trióxido de enxofre, segundo a reação abaixo:
2 SO2(g) + 1 O2(g) → 2 SO3(g)
Essa reação é usada na indústria como uma das etapas de produção do ácido sulfúrico. Visto que ela ocorre de forma lenta, os produtores precisam usar o catalisador dióxido de nitrogênio (NO2(g)) para acelerar o processo. Como ocorre com todos os sistemas gasosos, o catalisador (NO2(g)) forma com os reagentes (SO2(g) e O2(g)) um sistema monofásico.
Isso ocorre porque, numa primeira etapa da reação, o catalisador se combina com o dióxido de enxofre (SO2(g)) para formar o trióxido de enxofre (SO3(g)) e o monóxido de nitrogênio (NO(g)):
1ª etapa: 2 SO2(g) + 2 NO2(g) → 2 SO3(g) + 2 NO(g)
Em uma segunda etapa, o monóxido de nitrogênio reage com o outro reagente, o gás oxigênio (O2(g)); e o catalisador é reconstituído:
2ª etapa: 2 NO(g) + 1 O2(g) → 2 NO2(g)
Veja que a soma das duas etapas é exatamente igual à reação original sem o catalisador, o que prova que ele apenas acelera o processo da reação e não participa dela:
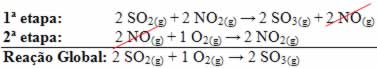
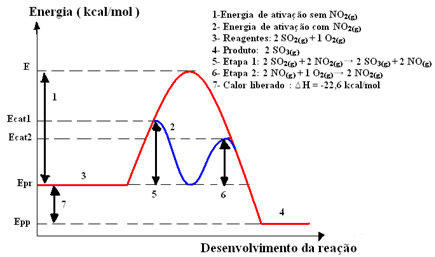
Visto que o catalisador mudou o mecanismo ou o caminho da reação, a energia de ativação desse processo é diminuída e a reação ocorre mais rapidamente, conforme o gráfico a seguir:
Outro exemplo de uma reação de catálise homogênea ocorre na decomposição do peróxido de hidrogênio: