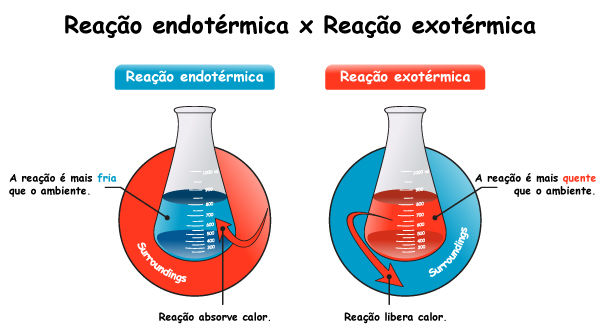
Reações endotérmicas e exotérmicas
Reações endotérmicas e exotérmicas são classificações das reações químicas baseadas na troca de energia, em forma de calor, com o ambiente. Nas reações exotérmicas, a energia é liberada, geralmente na forma de calor, tornando o ambiente ao redor mais quente. Esse tipo de reação é encontrado, por exemplo, na combustão da madeira, que libera energia na forma de calor e luz, aquecendo o ambiente. Por outro lado, nas reações endotérmicas, a situação é inversa: elas absorvem energia do ambiente, o que geralmente provoca um resfriamento ao redor, como é o caso do derretimento do gelo.
Leia também: Afinal, o que é calor?
Resumo sobre reações exotérmicas e endotérmicas
- Reações exotérmicas liberam energia para o ambiente na forma de calor, tornando-o mais quente.
- Reações endotérmicas absorvem energia do ambiente, causando resfriamento.
- A energia trocada nas reações está associada à entalpia, positiva em reações endotérmicas e negativa em exotérmicas.
- A compreensão desses processos é essencial para prever e manipular fenômenos em áreas como química industrial, biologia e tecnologia.
- Exemplos cotidianos incluem bolsas de gelo instantâneo (endotérmica) e aquecedores descartáveis (exotérmica).
Videoaula sobre reações endotérmicas e exotérmicas
O que são reações endotérmicas e exotérmicas?
As reações endotérmicas são aquelas que absorvem energia do meio ambiente para ocorrer. Em outras palavras, elas precisam de uma entrada de calor para que os reagentes possam se transformar em produtos. Como resultado, o ambiente ao redor da reação geralmente esfria, pois a energia é “retirada” dele.
Um exemplo comum é a fotossíntese, em que, para converter dióxido de carbono e água em glicose e oxigênio, as plantas absorvem energia luminosa do Sol. Outro exemplo é a decomposição térmica do carbonato de cálcio em óxido de cálcio e dióxido de carbono, reação que ocorre ao aquecer a substância.
Por outro lado, as reações exotérmicas são aquelas que liberam energia para o ambiente, geralmente na forma de calor. Essas reações são frequentemente associadas a um aumento de temperatura no ambiente ao redor.
Um exemplo clássico é a combustão, como quando madeira ou gasolina queimam, liberando energia em forma de calor e luz. Outro exemplo é a reação de neutralização entre um ácido e uma base, como entre o ácido clorídrico e o hidróxido de sódio, que resulta na formação de sal, água e liberação de calor.
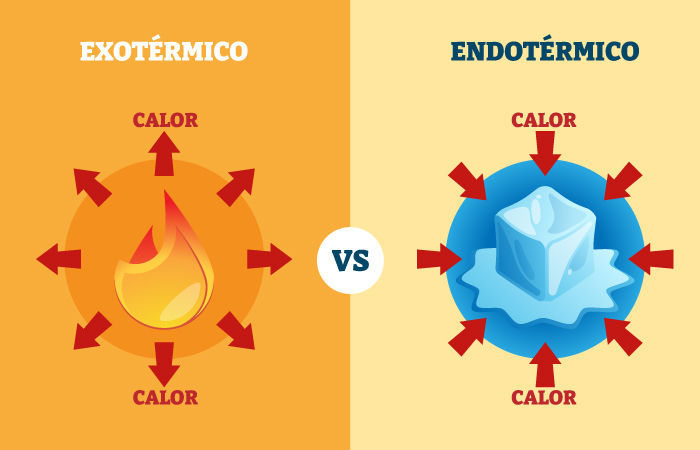
Qual a diferença entre reação endotérmica e reação exotérmica?
|
Reações endotérmicas |
Reações exotérmicas |
|
Absorvem calor do ambiente, ou seja, precisam de uma entrada de energia para ocorrer, o que geralmente deixa o ambiente ao redor mais frio. |
Liberam calor para o ambiente. Elas ocorrem naturalmente, e essa liberação de energia aquece o ambiente ao redor. |
Como identificar reações endotérmicas e exotérmicas?
Para identificar se uma reação é endotérmica ou exotérmica, podemos analisar a equação química da reação, em que é preciso observar o comportamento da energia (geralmente em forma de calor). Por exemplo, nas reações endotérmicas, o calor é um reagente, ou seja, é adicionado para que a reação ocorra. Em uma equação química, isso pode ser representado escrevendo-se a palavra “energia” ou “calor” ao lado dos reagentes, como é ilustrado a seguir:
CaCO3 + energia → CaO + CO2
Neste caso, a presença de energia como reagente indica que a reação absorve calor do ambiente.
Já nas reações exotérmicas, o calor é um produto, ou seja, é liberado no processo. Na equação química, a palavra “energia” ou “calor” aparece junto aos produtos. É o caso da combustão do metano:
CH4 + 2O2 → CO2 + 2 H2O + energia
Aqui, a presença de “energia” ao lado dos produtos indica que a reação libera calor.
Leia também: Diferença entre calor e temperatura
O que é entalpia?
A entalpia é uma grandeza termodinâmica que representa a quantidade total de energia de um sistema em condições constantes de pressão. Em outras palavras, ela mede a energia total que pode ser utilizada para realizar trabalho ou que é liberada ou absorvida durante reações químicas, especialmente as que ocorrem a pressão constante, a condição mais comum em muitos processos.
Matematicamente, ela (geralmente simbolizada por H) é definida pela soma da energia interna do sistema (U) e o produto da pressão (P) pelo volume (V):
H = U + PV
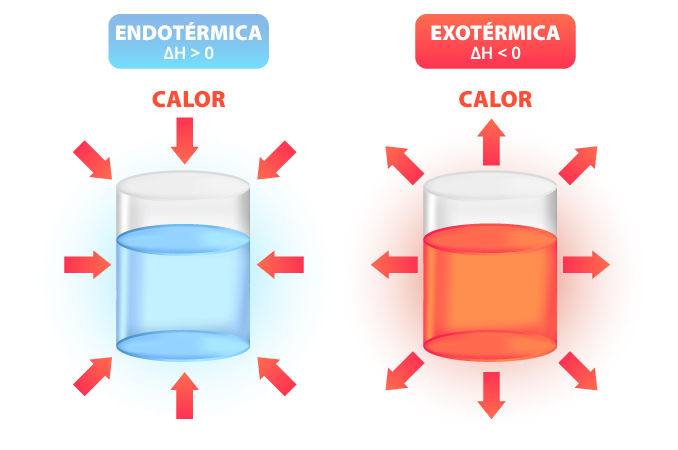
Mas não se preocupe, essa expressão é pouco usada, o que nos interessa, de fato, é calcular a variação da entalpia (ΔH). Para isso, usamos valores tabelados, obtidos por experimentos, para cada substância. Nesse sentido, quando uma reação ocorre, a variação de entalpia (ΔH) indica se a reação é endotérmica (ΔH > 0) ou exotérmica (ΔH < 0), conforme é ilustrado a seguir. Para entender melhor a entalpia, clique aqui.
Cálculo de reações endotérmicas e exotérmicas
Para calcular o calor envolvido em reações endotérmicas e exotérmicas, geralmente usamos o conceito de entalpia (∆H), que indica a variação de energia da reação. Sendo assim, para determinar o valor de ΔH, usamos as entalpias padrão de formação (ΔHf∘) dos reagentes e produtos.
E o que seria essa entalpia de formação? É basicamente a variação de energia associada à formação de um mol dessa substância com base em seus elementos em estado padrão; logo, o valor de ΔH para uma reação química pode ser calculado pela diferença entre a soma das entalpias dos produtos e a soma das entalpias dos reagentes.
\(\Delta H = \sum \Delta H_fº(produtos) - \sum \Delta H_fº(reagentes)\)
Nesse caso, se \(\Delta H\) é positivo, a reação é endotérmica; se \(\Delta H\) é negativo, a reação é exotérmica.
A fotossíntese, por exemplo, apresenta a equação química:
6 CO2 + 6 H2O → C6H12O6 + 6 O2
E os participantes dessa reação têm os seguintes valores de entalpia de formação:
- \(\Delta H_fº\) da glicose (C6H12O6): -1273 kJ/mol
- \(\Delta H_fº\) do CO2: - 393,5 kJ/mol
- \(\Delta H_fº\) do H2O(l): -285,8kJ/mol.
- \(\Delta H_fº\) do O2: zero em seu estado padrão.
Diante disso, temos:
\(\Delta H = [(-1.273) + 6 x (0)] - [6 x (-393,5) + 6 x (-285,8)]\)
\(\Delta H = (-1.273) - (-4.071,8)\)
\(\Delta H = + 2.802 kJ\)
É, portanto, um processo endotérmico já que é necessário absorver calor para acontecer.
Já na combustão do metano, para cada mol de CH4 queimado, são liberados 890 kJ de calor. O sinal negativo de ∆H mostra que a reação libera energia para o ambiente.
Para a reação de combustão do metano:
CH4 + 2 O2 → CO2 + 2 H2O
- \(\Delta H_fº\) do CH4: -74,8 kJ/mol
- \(\Delta H_fº\) do CO2: -393,5kJ/mol
- \(\Delta H_fº\) do H2O: -285,8kJ/mol
- \(\Delta H_fº\) O2 tem entalpia de formação zero.
Calculando ΔH
\(\Delta H = \left[ (-393,5) + 2 \times (-285,8) \right] - \left[ (-74,8) + 2 \times 0 \right] \)
\(\Delta H = (-393,5 - 571,6) - (-74,8) \)
\(\Delta H = -890 \, \text{kJ} \)
Exemplos de reações endotérmicas e exotérmicas no cotidiano
Existem diversos exemplos em nosso cotidiano de processos que envolvem absorção ou liberação de calor e que podem ser facilmente observados. Em vista disso, separamos alguns exemplos no quadro abaixo:
|
Endotérmica |
Exotérmica |
|
Fotossíntese nas plantas |
Combustão de combustíveis (gasolina, etanol, gás) |
|
Evaporação da água (como o suor) |
Queima de madeira em lareiras e fogueiras |
|
Bolsas de gelo instantâneas para lesões |
Reações de neutralização (antiácidos) |
|
Sublimação do gelo seco (dióxido de carbono sólido) |
Respiração celular nos organismos |
|
Reação entre bicarbonato de sódio e vinagre |
Solidificação de cera líquida em velas |
|
Fusão do gelo (derretimento) |
Oxidação do ferro (ferrugem) |
|
Decomposição térmica do carbonato de cálcio (CaCO₃) |
Dissolução de hidróxido de sódio (NaOH) em água |
|
Cozimento de alimentos (assando bolo, por exemplo) |
Reações em aquecedores de mão descartáveis |
Exercícios resolvidos sobre reações endotérmicas e exotérmicas
1) (Cesmac) Na medicina veterinária, o cloreto de amônio (NH4Cl) é utilizado como acidulante da urina com o objetivo de evitar infecções. Para a produção do NH4Cl, é empregada a reação do ácido clorídrico (HCl) com amônia (NH3), representada abaixo:
HCl(aq) + NH3(aq) → NH4Cl(s) ΔH = ???
Com base nos valores das entalpias de formação do HCl (\(\Delta H_fº = -46 kJ\cdot mol^{-1}\)), NH3 (\(\Delta H_fº= -92 kJ\cdot mol^{-1}\)) e NH4Cl (\(\Delta H_fº= -314 kJ \cdot mol^{-1}\)), determine a variação de entalpia (ΔH) da reação acima e se o processo é endotérmico ou exotérmico.
a) -176 kJ/mol, endotérmico.
b) 314 kJ/mol, endotérmico.
c) -176 kJ/mol, exotérmico.
d) -138 kJ/mol, exotérmico.
e) 138 kJ/mol, endotérmico.
Gabarito: d
Sabendo a entalpia de formação dos reagentes e produtos, basta substituir na fórmula da variação de entalpia:
\(\Delta H = \sum \Delta H_fº(produtos) - \sum \Delta H_fº(reagentes)\)
\(\Delta H = [-314]-[(46)+(-92)]\)
\(\Delta H = -314-(-138)]\)
\(\Delta H = -176 kJ/mol\)
Uma vez que ΔH para essa reação deu negativo, significa então que a reação é exotérmica.
2) (UEA) - A calagem é uma etapa do preparo do solo para o cultivo agrícola em que materiais de caráter básico são adicionados ao solo para neutralizar a sua acidez, corrigindo o pH desse solo.
Os principais sais, adicionados ao solo na calagem, são o calcário e a cal virgem. O calcário é obtido pela moagem da rocha calcária, sendo composto por carbonato de cálcio (CaCO3) e/ou de magnésio (MgCO3). A cal virgem, por sua vez, é constituída de óxido de cálcio (CaO) e óxido de magnésio (MgO), sendo obtida pela queima completa (calcinação) do carbonato de cálcio (CaCO3).
(Fontes: Sítio http://alunosonline.uol.com.br/quimica/calagem.html e Sítio https://pt.wikipedia.org/wiki/Calagem . Acessados em 21/03/2017. Adaptados).
Ao apagar-se a cal, conforme reação abaixo,
CaO(s) + H2O(l) → Ca(OH)2 + 63,7 kJ
afirma-se que temos uma reação
a) endotérmica, que absorve 63,7 kJ.
b) exotérmica, que absorve 63,7 kJ.
c) exotérmica, que libera 63,7 kJ.
d) endotérmica, que libera 63,7 kJ.
Gabarito: c
Para determinar se uma reação química é endotérmica ou exotérmica por meio de sua equação química, na qual energia está representada na própria equação, basta verificar se essa energia está sendo representada nos reagentes ou nos produtos. Posto isso, a reação apresentada no texto é exotérmica, pois mostra que, ao formar o produto (CaOH)2, são liberados 63,7 KJ.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Termoquímica. In: Princípios de Química: Questionando A Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2018. p. 273–289.
FELTRE, R. Componente curricular: QuímiCa. In: Química. 7. ed. São Paulo: Editora Moderna LTDA, 2008. v. 2.
L. BROWN, T. et al. Termoquímica. In: Química: A Ciência Central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 169–221.