Distribuição eletrônica de íons
No texto Distribuição Eletrônica no Diagrama de Pauling, você aprendeu a realizar a distribuição eletrônica dos átomos no estado fundamental, quando possuem a mesma quantidade de prótons e elétrons, sendo neutros.
Por meio das instruções a seguir, você aprenderá como realizar essa mesma distribuição eletrônica no diagrama de Pauling no caso de íons.
Íons são átomos de elementos que ganharam ou perderam elétrons e ficaram carregados eletricamente. O cátion é o íon que perdeu um ou mais elétrons e ficou com carga positiva. Já o ânion é o íon que ganhou um ou mais elétrons e ficou com carga negativa.
A carga elétrica do íon corresponde à diferença entre o número de prótons (cargas positivas) e elétrons (cargas negativas). Por exemplo, se um cátion apresenta a carga 1+, quer dizer que ele perdeu um elétron. Sabemos disso porque ele ficou com um próton a mais, isto é, com uma carga positiva a mais. Se a carga for 2+ , ele perdeu dois elétrons e assim por diante.
Por outro lado, se a carga for igual a 1-, quer dizer que o átomo recebeu um elétron e se tornou um ânion. Se a carga elétrica for 2-, ele ganhou dois elétrons e assim sucessivamente.
Esses elétrons que são perdidos pelos ânions saem do último nível de energia, da camada de valência, que é a camada mais externa. O mesmo vale para os elétrons que são recebidos.
Assim, a distribuição eletrônica dos íons é feita de forma semelhante à dos átomos neutros, com apenas uma diferença:

Por exemplo, considere o cádmio, que no estado fundamental possui 48 elétrons, portanto a sua distribuição eletrônica é dada por:
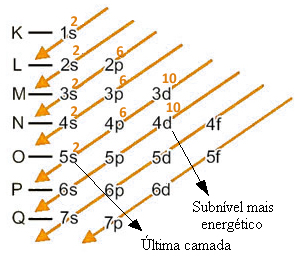
A distribuição eletrônica do átomo de cádmio em ordem energética, segundo o diagrama acima, fica assim: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.
Se fôssemos fazer a distribuição eletrônica do cátion bivalente desse elemento (Cd2+), teríamos que retirar 2 elétrons da última camada eletrônica, que é o 5s2:
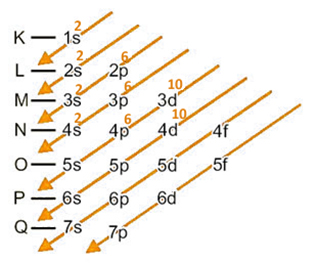
Distribuição eletrônica de Cd2+ em ordem energética: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 4d10.
Agora vamos ver um caso envolvendo um ânion:
- 53I1-
Primeiro fazemos a distribuição eletrônica para o átomo de iodo no estado fundamental, isto é, com 53 elétrons, que em ordem energética fica assim: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p5.
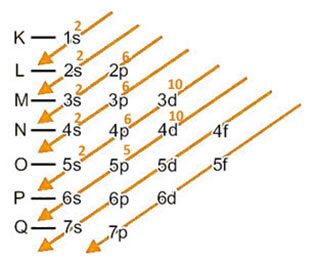
Agora acrescentamos o elétron ganhado no último nível e subnível, que é o 5p:
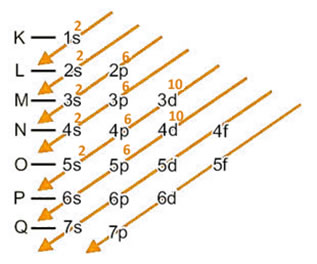
Distribuição eletrônica de 53I1- em ordem energética: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
No caso de não caber a quantidade de elétrons no subnível mais externo, passa-se para o próximo subnível.
No caso dos cátions, se não houver elétrons suficientes para serem retirados do subnível mais externo, retira-se a quantidade que falta do subnível anterior.

