Metais
Os metais são um grupo de elementos químicos abundantes no nosso planeta e que preenchem a maior parte da Tabela Periódica. Os metais podem ser transformados em lâminas em razão de sua característica maleável e em fios graças à propriedade de ductibilidade. Praticamente todos os metais apresentam brilho metálico característico, são bons condutores de calor e de energia e possuem altas temperaturas de fusão e de ebulição.
Considerando suas propriedades físico-químicas, os metais podem ser categorizados em: pesados, nobres, quebradiços, refratários, ferromagnéticos ou essenciais.
Na Tabela Periódica, os metais são classificados em subgrupos, de acordo com suas propriedades periódicas mais específicas, sendo agrupados em metais alcalinos, metais alcalinoterrosos ou metais de transição interna ou externa.
Leia também: Elementos transurânicos — quais são eles?
Resumo sobre metais
-
A maioria dos elementos da Tabela Periódica são metais.
-
Os metais ocorrem na natureza, frequentemente, sob a forma de minérios.
-
São sólidos em temperatura ambiente (com exceção do mercúrio) e apresentam brilho característico.
-
Podem ser moldados em lâminas e fios, porque possuem as propriedades de maleabilidade e ductibilidade, respectivamente.
-
São bons condutores térmicos e elétricos e costumam apresentar alta densidade e registrar altas temperaturas de fusão e de ebulição.
-
Têm baixa energia de ionização, formando cátions com facilidade, pela perda de elétrons.
-
De acordo com similaridades nas propriedades físico-químicas, os metais podem ser categorizados em: pesados, nobres, quebradiços, refratários, ferromagnéticos ou essenciais.
-
Na Tabela Periódica, o grande grupo dos metais pode ser subdividido de acordo com propriedades periódicas em: metais alcalinos, metais alcalinoterrosos e metais de transição interna e externa.
-
Sólidos metálicos são formados por meio de ligações metálicas.
-
As ligações metálicas são explicadas pela teoria do mar de elétrons.
-
Os minérios encontrados na natureza são a principal fonte de metais.
-
Os metais são amplamente utilizados pela civilização, possuindo enorme relevância comercial.
Videoaula sobre metais
Quais as características dos metais?
Os metais são uma grande classe de substâncias caracterizadas pela alta condutividade térmica e elétrica, maleabilidade, ductilidade e brilho característico. A maior parte dos metais pode ser encontrada da natureza junto de outros elementos químicos, sob a forma de minérios. Alguns podem ocorrer em sua forma pura, em razão de serem menos reativos e menos suscetíveis a processos de degradação.

Entre as propriedades físicas dos metais, destacam-se:
-
Estado físico: metais são sólidos em temperatura ambiente, exceto o mercúrio, que é líquido, e o gálio, que pode ser tornar líquido em torno de 30 °C.
-
Brilho: possuem uma superfície que reflete a luz incidente, e por isso se diz que eles apresentam brilho metálico, podendo ainda ser polidos.
-
Maleabilidade: possuem a capacidade de serem moldados sob o formato de lâminas finas ou folhas.
-
Ductibilidade: podem transformados em fios. Por exemplo, uma amostra de prata de 100 gramas pode se tornar um fio de 200 metros de comprimento.
-
Dureza: são duros. As únicas exceções são o sódio e o potássio, que são macios.
-
Condutibilidade: são bons condutores de calor e eletricidade. O caráter condutor se deve à presença de elétrons livres na estrutura do sólido metálico.
-
Densidade: de modo geral, possuem alta densidade e são pesados. O ósmio é o elemento conhecido de maior densidade (22,61 g/cm3), enquanto o lítio é o metal menos denso (0,54 g/cm3).
-
Pontos de fusão e ebulição: registram altas temperaturas de fusão e de ebulição. A exceção é o mercúrio, que possui os menores pontos de fusão e ebulição conhecidos, e o sódio e o potássio, que têm baixos pontos de fusão.
As propriedades químicas dos metais se referem à sua eletropositividade e reatividade. De modo geral, os metais têm caráter eletropositivo e formam cátions com facilidade. Essa tendência é justificada pela baixa energia de ionização característica desse grupo de elementos. Isso significa que metais possuem alta tendência em perder elétrons durante a ocorrência de uma reação química, sendo facilmente oxidados e originando íons positivos de diferentes valências.
-
Metais do grupo 1 possuem apenas um elétron na subcamada s, por isso formam cátions monovalentes:
\(Na\ \rightarrow{\ Na}^{+\ }+{\ e}^-\)
-
Metais do grupo 2 têm dois elétrons na subcamada s, formando cátions divalentes:
\(Ca\ \rightarrow{\ Ca}^{2+\ }+{\ 2\ e}^-\)
-
Os metais de transição geralmente perdem os dois elétrons de valência, originando íons de carga 2+. No entanto, também podem formar cátions mono ou trivalentes:
\(Al\rightarrow\ {Al}^{3+\ }+\ {3\ e}^-\)
Além disso, alguns metais são altamente reativos em contato com a água, como o sódio, o potássio e, de forma mais amena, o cálcio, estabelecendo uma reação química altamente exotérmica. Em contato com o oxigênio, os metais reagem formando óxidos metálicos de natureza básica. Os metais reagem com ácidos, formando gás hidrogênio e sal metálico. Em contato com bases, nem todos os metais são reativos.
Quais são os tipos de metais?
O grande grupo dos metais pode ser categorizado em agrupamentos mais específicos, de acordo com similaridades nas propriedades físico-químicas. Veja a seguir.
-
Metais pesados
Os metais pesados possuem alta densidade e são tóxicos mesmo em baixas concentrações. Por isso, devem ser monitorados em análises de água, alimentos e medicamentos. Os principais representantes desse grupo são o arsênio, o cádmio, o chumbo e o mercúrio.
-
Metais nobres
Os metais nobres se diferenciam dos demais pelo fato de que são pouco reativos e não são facilmente oxidados. Os metais nobres geralmente são preciosos e de rara ocorrência natural. Dentro dessa classe se destacam o ouro, a platina, o ródio, o irídio e o paládio. Os elementos que não pertencem aos metais nobres podem ser chamados de metais básicos.
-
Metais quebradiços
Os metais quebradiços não apresentam ductibilidade e maleabilidade (embora quase a totalidade dos metais apresente essas características), não podendo ser transformados em folhas ou fios. Representam esse grupo o berílio, o cromo, o manganês, o gálio e o bismuto.
-
Metais refratários
Metais refratários são extremamente resistentes ao desgaste e a altas temperaturas. Seus pontos de fusão ultrapassam os 2000 °C. Fazem parte desse grupo o nióbio, o molibdênio, o rênio e o tungstênio.
-
Metais ferromagnéticos
Metais ferromagnéticos magnetizam-se fortemente, sendo atraídos por ímãs quando na presença de um campo magnético. O ferro é classicamente conhecido pela sua propriedade magnética, mas o cobalto e o níquel também apresentam esse comportamento.
-
Metais essenciais
Metais essenciais são aqueles elementos que desempenham funções metabólicas nos organismos vivos, como o ferro, zinco, magnésio, cobre, cálcio, potássio, sódio, níquel, cobalto, entre outros.
Metais da Tabela Periódica
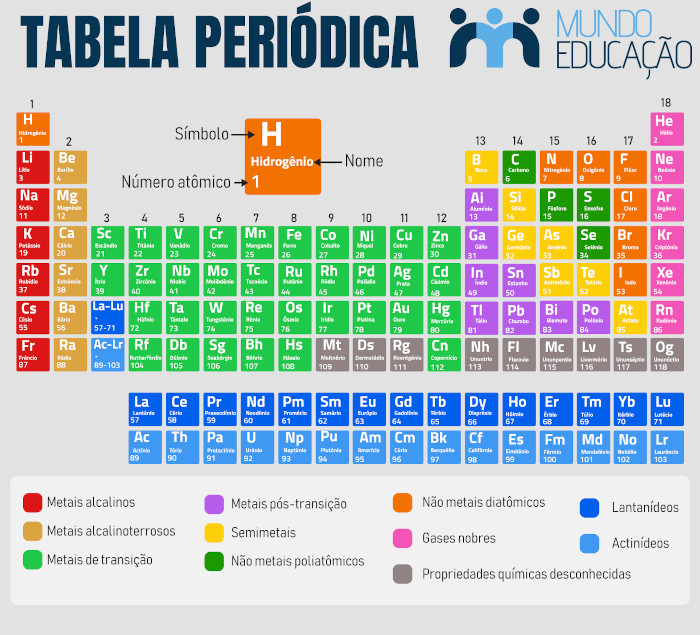
Para baixar a Tabela Periódica, clique aqui.
Dos 118 elementos químicos que compõem a Tabela Periódica, 95 são metais ou possuem comportamento metálico. A região central e o lado esquerdo da Tabela Periódica contêm os elementos metálicos. No lado direito ficam localizados os elementos não metálicos.
A Tabela Periódica é organizada de maneira que elementos com propriedades similares se repitam nas famílias e grupos de maneira recorrente. Assim, os diferentes elementos metálicos estão dispostos na Tabela Periódica em função de suas similaridades. Veja as seguir os grupos metálicos presentes na Tabela Periódica.
-
Metais alcalinos
Metais alcalinos é o nome dado ao grupo 1 da Tabela Periódica, formado pelo lítio, sódio, potássio, rubídio, césio e frâncio. O sódio e o potássio são abundantes, facilmente encontrados na natureza, e são metais essenciais. O lítio, o rubídio e o césio são metais raros, e o frâncio é instável e radioativo. O hidrogênio, apesar de fazer parte do grupo 1, não é metal.
Esses elementos são os metais de maior reatividade, podendo gerar explosões em contato com a água. São muito macios, maleáveis, dúcteis, brilhantes e bons condutores de calor e eletricidade. Possuem apenas um elétron na camada de valência.
-
Metais alcalinoterrosos
Metais alcalinoterrosos é a denominação para os elementos do grupo 2 da Tabela Periódica, formado pelo berílio, magnésio, cálcio, estrôncio, bário e rádio. O magnésio e o cálcio são muito abundantes na crosta terrestre e são essenciais aos organismos vivos. O berílio, o estrôncio e o bário são de ocorrência rara. O rádio é um elemento radioativo.
Esses elementos são considerados reativos, mas em menor extensão do que os metais do grupo 1. Possuem as clássicas características metálicas e podem apresentar brilho metálico. Possuem dois elétrons ocupando o nível s mais externo.
-
Metais de transição externa
Conhecidos também apenas como metais de transição, os metais de transição externa são o maior grupo da Tabela Periódica, englobando os grupos 3 a 12. Exemplos de metais presentes nesse grupo são o ferro, o ouro, o cobre e a prata.
Esses elementos são dúcteis, maleáveis, bons condutores de eletricidade, densos e apresentam brilho metálico característico. Possuem altos pontos de fusão e ebulição. São menos reativos do que os metais alcalinos e alcalinoterrosos.
De acordo com a Iupac, os elementos (ou metais) de transição são aqueles que possuem um subnível d incompleto ou que conseguem formar cátions com um subnível d incompleto. Devido a essa configuração eletrônica, podem apresentar diferentes estados de oxidação.
-
Metais de transição interna
Os metais ou elementos de transição interna são aqueles que ocupam os grupos 6 e 7 e, normalmente, são representados fora do corpo principal da Tabela Periódica. A característica principal desses elementos é que seus elétrons mais externos chegam a ocupar o subnível f.
◦ Lantanídeos: Os elementos que estão no sexto período são chamados de lantanídeos em razão do primeiro elemento da série, o lantânio. Esses metais têm aspecto prateado e são conhecidos como “terras-raras”, por causa da sua baixa ocorrência natural.
◦ Actinídeos: Os metais presentes no sétimo período compõem a série dos actinídeos, em razão de o primeiro elemento ser o actínio. São elementos instáveis e praticamente inexistentes na natureza, sendo obtidos apenas em laboratórios.
Saiba mais: Ponto de fusão e ponto de ebulição na Tabela Periódica
Ligações químicas dos metais
A ligação química que se estabelece entre elementos metálicos é denominada ligação metálica. O modelo proposto para explicar a natureza dessa ligação considera a facilidade dos átomos metálicos em perder seus elétrons, ou seja, sua energia de ionização relativamente baixa.
Assim, quando átomos metálicos se unem para formar um sólido metálico, os elétrons das camadas mais externas deixam seu “átomo original” e passam a se movimentar livremente por todos os átomos da estrutura, constituindo uma espécie de nuvem de elétrons ou mar de elétrons.
Os átomos metálicos, ao perderem elétrons, transformam-se em íons positivos (cátions) que possuem posições fixas na estrutura formada. A força da ligação metálica deriva da atração eletrostática entre cátions de posição fixa na estrutura e elétrons que se movimentam livremente ao longo dela. Esse modelo é conhecido como teoria do mar de elétrons e é capaz de explicar as propriedades físicas dos metais.
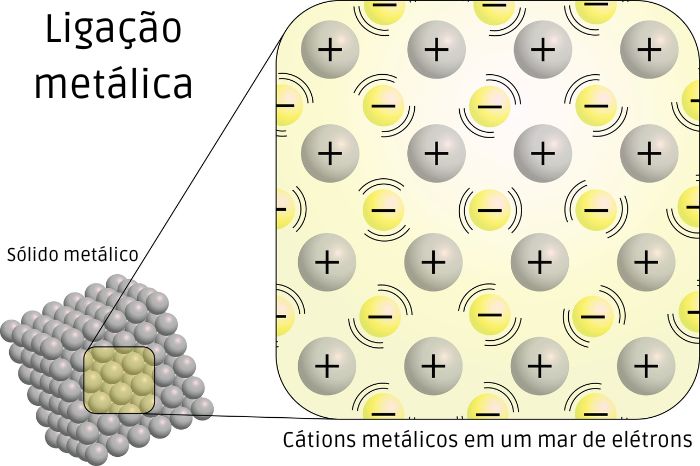
Por exemplo, a maleabilidade e a ductilidade dos metais se devem à facilidade de ajuste dos elétrons quando os cátions têm suas posições alteradas, uma vez que os elétrons são livres. As propriedades de condução de eletricidade e de calor também são explicadas pela facilidade de movimentação dos elétrons ao longo da estrutura.
Atualmente, teorias mais modernas são utilizadas para explicar e validar as ligações metálicas baseadas em conceitos de química quântica. Contudo, para entendermos as propriedades dos metais, a teoria do mar de elétrons é suficiente.
-
Videoaula sobre ligação metálica
Obtenção dos metais
A crosta terrestre possui uma enorme variedade de metais, que ocorrem geralmente combinados a outros elementos químicos, sob a forma de minérios. Apenas alguns metais podem ocorrer naturalmente em sua forma pura, indicando sua característica de baixa reatividade, como o ouro, a prata e a platina. Para obter o metal por meio de seu minério, é necessária uma sequência de etapas, a fim de remover impurezas e isolar o metal na sua forma pura.
A mineração é o trabalho de extrair os minérios da terra ou de minas, e a metalurgia é o ramo responsável pela obtenção de metais por meio de seus minérios. A siderurgia é um ramo da metalurgia específico para o ferro, dada a sua importância econômica.
O procedimento de redução eletrolítica, ou eletrólise, é muito utilizado para isolar metais de caráter mais reativo de seus minérios. Esse procedimento é aplicado para a obtenção de sódio, magnésio e cálcio, por exemplo.
Metais que não são tão reativos podem ser obtidos por meio de reações químicas de queima, ou calcinação. Nesse método, o minério é convertido ao óxido do metal pelo aquecimento em altíssima temperatura na presença de ar oxigênio em excesso. Metais como o zinco, o cobre e o chumbo podem ser isolados dessa maneira.
Alguns metais podem ser extraídos por meio de seus óxidos na reação com carbono, em altas temperaturas. A condição para isso é que o metal seja menos reativo do que o próprio carbono. Esse processo funciona muito bem para o zinco, ferro, cobre, chumbo e estanho. Nesse procedimento, o carbono reage com o oxigênio para formar dióxido de carbono, reduzindo o metal à sua forma pura, de acordo com a equação geral abaixo:
\(óxido\ metálico+carbono→metal+dióxido\ de\ carbono\)
O ferro é o metal de maior importância comercial no Brasil e pode ser extraído de seus minérios, que geralmente estão sob a forma de óxidos. Os minérios de ferro mais conhecidos são a hematita, a magnetita e a siderita. Esse processo de extração ocorre em um equipamento conhecido como alto-forno, em temperatura que pode alcançar 1500 °C.

Os metais possuem uma importância incalculável para as civilizações modernas. Alguns metais são aplicados em sua forma pura, mas é muito comum o uso de ligas metálicas, que são misturas formadas por dois ou mais elementos e que adquirem novas propriedades em relação aos seus materiais de origem. O aço é uma das ligas metálicas de maior importância, sendo composto basicamente por ferro e carbono e pequenas quantidades de fósforo, enxofre e silício.
Saiba também: Alotropia — a capacidade de um elemento químico formar duas ou mais substâncias simples
Diferenças entre metais e ametais
Todos os elementos da Tabela Periódica podem ser classificados em metais ou ametais. Os ametais são um grupo de elementos químicos que possuem propriedades físico-químicas opostas às dos metais. A tabela abaixo reúne as principais diferenças entre esses dois grupos.
|
|
Metais |
Ametais |
|
Estado físico (a 20 °C) |
Sólidos (exceto mercúrio) |
Sólidos, líquidos e gasosos |
|
Aparência visual |
Brilhosos |
Opacos |
|
Capacidade de deformação |
Maleáveis e dúcteis |
Quebradiços |
|
Condução elétrica e térmica |
Bons condutores |
Maus condutores |
|
Energia de ionização |
Baixa (perdem elétrons com facilidade) |
Alta (não perdem elétrons com facilidade) |
|
Eletronegatividade |
Baixa (fraca tendência em atrair elétrons) |
Alta (forte tendência em atrair elétrons) |
A energia de ionização é uma propriedade que diferencia muito bem os metais dos ametais. Enquanto os metais possuem baixas energias de ionização, perdendo seus elétrons com facilidade, os ametais são bastante eletronegativos, ou seja, têm forte tendência em atrair elétrons de outros átomos ao invés de perder os seus elétrons.
Na Tabela Periódica, os metais ocupam a extremidade esquerda, e os ametais estão posicionados do lado direito da tabela. A exceção é o hidrogênio, que apesar de ser não metal, está posicionado no grupo 1.
Importante: Até há algum tempo, era comum encontrar outras subdivisões para classificar os elementos além de em metais e ametais, como em metaloides ou semimetais. Atualmente, esses termos estão sendo descontinuados na literatura química.
Exercícios resolvidos sobre metais
Questão 1
(IFTO 2018) No laboratório, após observar características como brilho e maleabilidade e realizar alguns testes qualitativos, foi feita uma classificação entre elementos metálicos e não metálicos. Assinale a opção que descreve corretamente as características dos metais.
A) Não têm brilho; condutores de calor e eletricidade; tendem a formar ânions em solução aquosa.
B) Os óxidos são sólidos iônicos básicos; têm brilho; pobres condutores de calor e eletricidade.
C) Os óxidos são substâncias moleculares; tendem a formar cátions em soluções aquosas; são dúcteis.
D) Condutores de calor e eletricidade; tendem a formar cátions em soluções aquosas; são maleáveis.
E) Condutores de calor e eletricidade; tendem a formar cátions em soluções aquosas; quando sólidos são quebradiços e alguns são duros e outros macios.
Resolução:
Alternativa D
Os metais têm como principais características a alta condutividade térmica e elétrica, a maleabilidade, a ductilidade e o brilho metálico característico. São elementos eletropositivos, pois têm baixa energia de ionização. Isso significa que possuem forte tendência em formar cátions. Além disso, os metais estabelecem ligações metálicas, de acordo com a teoria do mar de elétrons.
Dessa forma, apenas o item D reúne características pertencentes aos metais. Apesar de o item E indicar corretamente as características, ele informa que os metais são quebradiços quando sólidos, o que não é verdade, uma vez que esses elementos são dúcteis e maleáveis. Apenas alguns pouquíssimos metais são quebradiços.
Questão 2
(EAM 2011) Em relação às ligações químicas, é correto afirmar que a ligação metálica consiste em:
A) um mar de elétrons circulando entre cátions fixos.
B) inúmeros íons mantidos unidos como que em uma grade.
C) um mar de elétrons circulando ânions fixos.
D) um mar de prótons circulando ânions fixos.
E) milhares de átomos mantidos unidos por compartilhamento de elétrons.
Resolução:
Alternativa A
A teoria mais difundida para explicar a ligação metálica é a teoria do mar de elétrons, que está baseada na facilidade dos metais em perderem elétrons da camada mais externa. Assim, em um sólido metálico, os átomos dos metais se organizam em uma estrutura chamada de retículo cristalino, onde possuem posições fixas.
Os elétrons mais externos de cada átomo (por estarem menos fortemente atraídos pelo núcleo) conseguem se movimentar livremente entre os átomos metálicos da estrutura. Ao perderem esses elétrons de valência, os átomos metálicos se transformam em íons positivos (cátions), que ficam rodeados por um mar de elétrons. Essa teoria é importante porque explica muitas das propriedades dos metais, como a condução de calor e de eletricidade.

