Efeito do Íon Comum
O principio de Le Chatelier diz que quando se aplica uma força sobre determinado equilíbrio químico, a sua tendência é se reajustar para minimizar os efeitos dessa força, procurando voltar à situação de equilíbrio inicial.
É exatamente isso o que ocorre quando adicionamos a um equilíbrio iônico um íon já existente no meio. Nesse momento o equilíbrio será deslocado no sentido de diminuir a concentração em quantidade de matéria do íon em questão. Isso sempre acontece e é um fenômeno denominado de Efeito do Íon Comum.
Por exemplo, digamos que temos uma solução aquosa de um ácido genérico (HA(aq)) em equilíbrio iônico, como mostrado a seguir:
HA(aq) + H2O(?) ↔ H3O1+(aq) + A1-(aq)
Se adicionarmos à solução um sal desse ácido (CA) ele irá sofrer uma dissociação em meio aquoso:
CA(s) + H2O(?) ↔ C1+(aq) + A1-(aq)
Observe que o ânion A1-(aq) já existia no meio, portanto, ele é o íon comum. Visto que agora ele está em excesso, segundo o principio de Le Chatelier, irá ocorrer um deslocamento do equilíbrio para o sentido inverso, com a finalidade de diminuir a ionização do ácido HA(aq), consumindo os íons A1-(aq).

O efeito do íon comum tem a função de diminuir o grau de ionização do ácido. Desse modo, o valor da constante do equilíbrio não se altera.
Antes de adicionar o sal, a constante de equilíbrio do ácido (Ka) era dada por:
Ka = [H3O1+] . [ A1-]
[HA]
Observe que, quando adicionamos o sal, o íon A1-(aq) aumenta, mas ao mesmo tempo a concentração do ácido HA também aumenta, o que mantém o valor de Ka constante, desde que esteja a uma mesma temperatura.
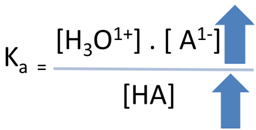
Esse efeito comum também ocorre com soluções básicas de forma análoga ao que foi visto aqui, sendo que sua função nesse caso é a de diminuir a dissociação da base.
Esse tipo de efeito é o responsável pela capacidade que as soluções-tampão possuem de praticamente não sofrer variação de pH ou pOH pela adição de pequenas quantidades de ácidos fortes ou bases fortes em seu meio.

