Entalpia de solução
A entalpia de solução é a variação de entalpia envolvida no processo em que ocorre a adição de dada quantidade de soluto em um solvente, em pressão e temperatura constantes. A entalpia de solução, quando negativa, indica que a dissolução da substância foi acompanhada de liberação de calor e consequente aumento da temperatura. Do contrário, se for positiva, indica que a dissolução da substância foi acompanhada de absorção de calor e consequente diminuição da temperatura.
Leia também: Quais são os tipos de entalpia?
Resumo sobre a entalpia de solução
- A entalpia de solução é a variação de entalpia associada à adição de uma quantidade de soluto em uma quantidade de solvente, em pressão e temperatura constantes.
- Pode ser tanto positiva, quando o processo de solubilização ocorre mediante absorção de calor, ou negativa, quando o processo de solubilização ocorre mediante liberação de calor.
- A entalpia de solução é consequência do balanço energético entre as entalpias para as interações que existem entre as partículas do soluto e do solvente.
- Faz parte do grupo de entalpias de processos químicos, que contrastam com as entalpias de processos físicos.
O que é entalpia de solução?
![Fórmula de cálculo da entalpia de uma solução junto à ilustração da formação de uma solução (soluto + solvente). [imagem_principal]](https://static.mundoeducacao.uol.com.br/mundoeducacao/2025/06/solucao-entalpia.jpg)
A entalpia (ou calor) de solução é a variação de entalpia associada com a adição de dada quantidade de um soluto em uma dada quantidade de solvente, em pressão e temperatura constantes.
X + n Solv → X ∙ nSolv ΔHsol.
Na reação genérica descrita anteriormente, um mol de soluto X é adicionado a n mols de solvente (Solv), formando uma solução entre ambos. A variação de entalpia para o processo, ΔHsol., é dada como entalpia de solução.
A dissolução do cloreto de hidrogênio em água, por exemplo, apresenta uma variação de entalpia negativa (−74,85 kJ/mol), indicando que a dissolução desse composto em água ocorre com liberação de energia na forma de calor.
HCl (g) → HCl (aq) ΔHsol. = −74,85 kJ/mol
Como calcular a entalpia de solução?
A entalpia de solução pode ser calculada a partir da ideia de que é necessário, em teoria, para a formação de uma solução:
- o rompimento das interações entre os componentes do soluto (ΔHsoluto-soluto);
- o rompimento das interações entre as moléculas do solvente (ΔHsolvente-solvente) e a formação de novas interações entre as moléculas do solvente e do soluto (ΔHsoluto-solvente).
Assim, temos que a entalpia de solução pode ser calculada pelo seguinte balanço energético:
ΔHsol. = ΔHsoluto-solvente + ΔHsoluto-soluto + ΔHsolvente-solvente
Nesse balanço, espera-se que os processos de rompimento das ligações soluto-soluto e das interações solvente-solvente sejam endotérmicos, assim como a nova interação soluto-solvente seja exotérmica, uma vez que esta deve ser energeticamente mais favorável.
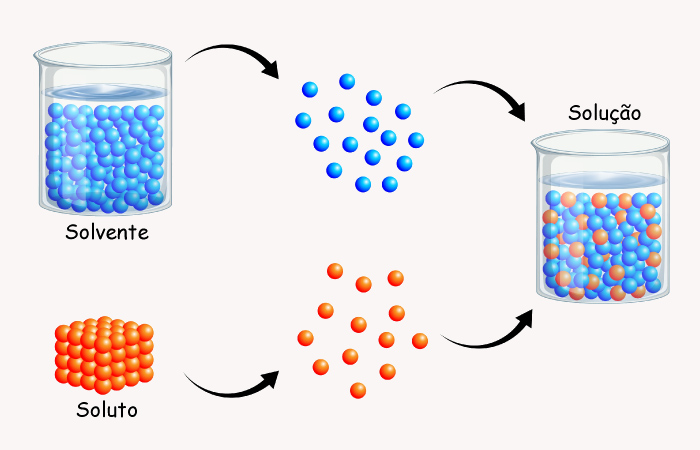
Se o composto apresenta ΔHsol. < 0, isso significa que sua dissolução vem acompanhada macroscopicamente de um aumento de temperatura, indicando que a formação da interação soluto-solvente supera energeticamente o rompimento das interações soluto-soluto e solvente-solvente.
Do contrário, se ΔHsol. > 0, tem-se que o processo de dissolução ocorre mediante utilização de energia para separação das interações soluto-soluto e solvente-solvente, uma vez que a nova interação soluto-solvente não é suficiente para superar tais forças atrativas. Macroscopicamente, observa-se a diminuição da temperatura do sistema.
Leia também: Diferença entre reações endotérmicas e exotérmicas
Como ocorre a entalpia de solução?
O balanço energético da entalpia de solução já determina as condições necessárias para a ocorrência de uma dissolução: deve-se romper interações soluto-soluto e solvente-solvente para a formação de novas interações soluto-solvente.
Alguns efeitos são percebidos no processo de dissolução: em primeiro lugar, quanto mais solvente é utilizado, maior, em termos de módulo, é o valor de ΔHsol., uma vez que um maior número de interações estão sendo rompidas e formadas. Obviamente que existe um limiar, o qual é conhecido como “diluição infinita”. No caso do HCl, por exemplo:
HCl (g) + 10 H2O (l) → HCl∙10H2O (aq) ΔH(1)sol. = −69,01 kJ/mol
HCl (g) + 25 H2O (l) → HCl∙25H2O (aq) ΔH(2)sol. = −72,03 kJ/mol
HCl (g) + 40 H2O (l) → HCl∙40H2O (aq) ΔH(3)sol. = −72,79 kJ/mol
HCl (g) + 200 H2O (l) → HCl∙200H2O (aq) ΔH(4)sol. = −73,96 kJ/mol
HCl (g) + ∞ H2O (l) → HCl∙∞H2O (aq) ΔH(∞)sol. = −74,85 kJ/mol
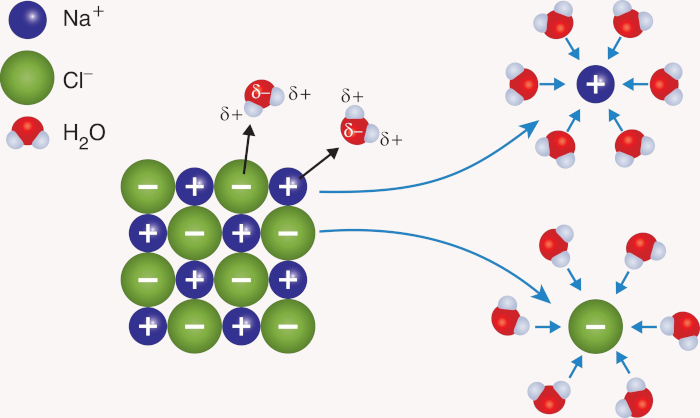
Para compostos iônicos, devemos entender algumas questões: em primeiro lugar, as interações íon-íon, de natureza eletrostática, são muito mais fortes que as interações solvente-solvente, as quais tendem a ser do tipo dipolo-dipolo (ou até mesmo ligação de hidrogênio). As interações íon-dipolo, que são as interações entre o soluto e o solvente, também são mais fracas que as interações íon-íon, contudo, mais fortes que as interações solvente-solvente.
Além do mais, em um sistema de dissolução, há um grande número de interações íon-dipolo que atuam em cada íon, o que gera um acréscimo sobre a interação soluto-solvente, tornando-a da mesma ordem de grandeza das interações entre os íons dos solutos (soluto-soluto). Como consequência desse efeito, as interações solvente-solvente acabam sendo negligenciadas, já que são muito menores que as demais interações. Como consequência, para um composto iônico, a entalpia de solução fica reduzida a:
ΔHsol. = ΔHsoluto-solvente + ΔHsoluto-soluto
Na separação dos íons, utiliza-se uma outra entalpia, conhecida como entalpia de rede (ΔHrede), que apresenta a energia necessária para a separação dos íons do retículo cristalino em um gás de íons, sendo um processo altamente endotérmico. Por exemplo, para o NaCl:
NaCl (s) → Na+ (g) + Cl− (g) ΔHrede = + 787 kJ/mol
Já a formação das interações soluto-solvente é também chamada de solvatação (ou hidratação, no específico caso em que o solvente é a água), que consiste na organização das moléculas do solvente em torno do íon dissolvido. É sempre um processo exotérmico, uma vez que resulta na formação de novas interações entre moléculas isoladas e uma carga disponível no meio. Para o NaCl em água, temos que a entalpia de solvatação (ΔHsolv.) ou entalpia de hidratação (ΔHhid.) é:
Na+ (g) + Cl− (g) → Na+ (aq) + Cl− (aq) ΔHsolv. = − 783 kJ/mol
Assim sendo, a dissolução do NaCl é levemente endotérmica:
ΔHsol. = +787 – 783 = + 4 kJ/mol
Tipos de entalpia
Basicamente, podemos dividir os tipos de entalpia em dois grupos: os de processos físicos e os de processos químicos. Iremos citar alguns casos a seguir, mas o mais importante, no caso, é saber distinguir a entalpia quanto à natureza do processo.
1) Entalpias de processos físicos
- Entalpia de vaporização: apresenta a variação de entalpia durante o processo de vaporização, em que o líquido absorve energia, na forma de calor, para se tornar um gás. É sempre endotérmica.
- Entalpia de fusão: apresenta a variação de entalpia durante o processo de fusão, em que um sólido deve absorver energia, na forma de calor, para se tornar um líquido. É sempre endotérmica.
- Entalpia de liquefação (ou condensação): apresenta a variação de entalpia durante o processo de liquefação, em que o gás se torna líquido, com consequente liberação de energia na forma de calor. É sempre exotérmica e exatamente o inverso da entalpia de vaporização (ΔHliq. = −ΔHvap.).
- Entalpia de solidificação: apresenta a variação de entalpia durante o processo de solidificação, em que o líquido se torna sólido, com consequente liberação de energia na forma de calor. É sempre exotérmica e exatamente o inverso da entalpia de fusão (ΔHsolid. = −ΔHfus.).
- Entalpia de sublimação: apresenta a variação de entalpia durante o processo de sublimação, em que o sólido se torna gás, sem passar pelo estado líquido, com absorção de energia na forma de calor. Como a entalpia é uma função de estado, a entalpia de sublimação é o somatório da entalpia de fusão com a entalpia de vaporização (ΔHsubl. = ΔHfus. + ΔHvap.). Se estivermos falando do processo contrário, ou seja, a passagem do estado gasoso direto para o estado sólido, então a variação de entalpia será exatamente o oposto, ou, simplesmente, o somatório das variações de entalpia de liquefação e solidificação (ΔHsubl. = ΔHliq. + ΔHsolid.).
2) Entalpias de processos químicos
- Entalpia de combustão: apresenta a variação de entalpia para o processo químico de combustão, que sempre será exotérmico, dada a grande quantidade de energia liberada na forma de calor (ΔHcomb.).
- Entalpia de formação: apresenta a variação de entalpia para uma reação química de formação, que consiste na síntese de 1 mol de uma substância composta a partir de suas substâncias simples mais estáveis em condições ambiente (ΔHf).
- Entalpia de ligação: apresenta a energia envolvida, na forma de calor, para quebrar ou formar uma ligação química. As quebras de ligação são sempre endotérmicas, enquanto a formação de ligações é sempre exotérmica.
- Entalpia de rede: apresenta a energia necessária, na forma de calor, para vaporizar um sólido em um gás de íons muito espaçados, em pressão constante. A entalpia de rede é sempre endotérmica.
Leia também: Termoquímica — ramo que estuda as trocas de calor associadas às reações químicas e mudanças de estado
Exercícios resolvidos sobre entalpia
Questão 1
(UFRR 3ª Etapa/2023) Sabendo que a entalpia de dissolução do nitrato de amônio é de 21,1 kJ∙mol-1,
(NH4)NO3 (s) → NH4+ (aq)+ NO3 (aq) ∆H = +21,1 kJ∙mol-1
É CORRETO afirmar que:
A) O processo é exotérmico.
B) Calor é liberado para o ambiente durante o processo de dissolução.
C) O processo é endotérmico.
D) O sal não é solúvel.
E) Nenhuma das anteriores.
Resposta: Letra C.
Percebe-se que o nitrato de amônio possui um processo de dissolução endotérmico, pois a variação de entalpia para o processo é positiva (+21,1 kJ∙mol−1).
Questão 2
(Unimontes) Durante o processo de dissolução de um soluto, ocorre a separação das moléculas do soluto e do solvente e a formação das interações soluto e solvente. Cada uma dessas etapas contribui com um fator entalpia (ΔHº) no calor total de dissolução (ΔHºdiss). Dessa forma, a formação de uma solução pode tanto ser exotérmica quanto endotérmica. O diagrama abaixo ilustra a dissolução de dois líquidos.
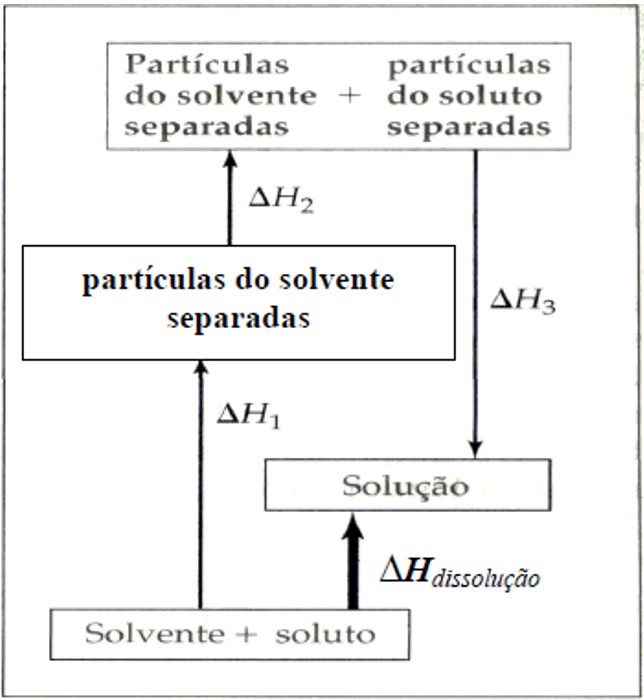
Considerando as informações do texto e as do diagrama, conclui-se que:
A) as forças soluto-solvente são mais fracas do que as forças entre soluto e solvente puros.
B) as forças atrativas, tanto no soluto puro quanto no solvente puro, são da mesma intensidade.
C) a temperatura da solução se reduz em função da dissolução que ocorre espontaneamente.
D) o processo de separação das moléculas, tanto do soluto quanto do solvente, é exotérmico.
Resposta: Letra A.
Ao se observar o diagrama, percebe-se que:
- ΔH1 = energia necessária para separar as partículas do solvente (processo endotérmico);
- ΔH2 = energia necessária para separar as partículas do soluto (processo endotérmico);
- ΔH3 = energia liberada ao se formar as interações soluto-solvente (processo exotérmico);
- ΔHdissolução = energia total necessária para a dissolução do soluto no solvente (processo endotérmico).
Vale ainda dizer que:
ΔHdissolução = ΔH1 + ΔH2 + ΔH3
Percebemos, portanto, que, para a dissolução apresentada na questão, o processo é endotérmico, pois a energia necessária para romper as interações entre as partículas do solvente e do soluto (somatório ΔH1 + ΔH2) é maior que a energia liberada na formação de novas interações soluto-solvente ΔH3. Percebe-se também que a força de interação do solvente é maior que do soluto (pois ΔH1 > ΔH2).
Portanto, concluímos que a interação entre soluto-solvente é mais fraca do que as forças entre soluto e solvente puros.
Fontes
ATKINS, P.; DE PAULA, J.; KEELER, J. Physical Chemistry. 11. ed. Oxford: Oxford University Press, 2018.
CASTELLAN, G. Fundamentos de Físico-Química. 1. ed. Barueri: LTC Editora, 1986.
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
SILVA, L. A.; MARTINS, C. R.; DE ANDRADE, J. B. Por que todos os nitratos são solúveis? Química Nova. vol. 27, n. 6. p. 1016-1020. 2004

