Alcalose e Acidose no organismo humano

O sangue funciona como uma solução-tampão, que evita que o seu pH sofra grandes alterações. O pH do sangue e dos fluidos extracelulares se mantém na faixa entre 7,35 a 7,45.
Esse pH se deve ao fato de que as células de nosso corpo produzem continuamente dióxido de carbono (CO2(aq)) como produto terminal do metabolismo. Parte desse CO2 se dissolve no sangue, estabelecendo um equilíbrio iônico ácido carbônico/ hidrogenocarbonato (bicarbonato) (H2CO3(aq)/ HCO3-(aq)):
CO2(aq) + H2O(l) ↔ H2CO3(aq) ↔ H+(aq) + HCO3-(aq)
É esse equilíbrio que mantém o pH do sangue em aproximadamente 7,4, tendo uma razão normal entre o HCO3-(aq) e o H2CO3 de 20:1, respectivamente.
Se essa razão for alterada de alguma forma, pode causar sérios danos ao organismo, com profundas alterações metabólicas, podendo causar a morte.
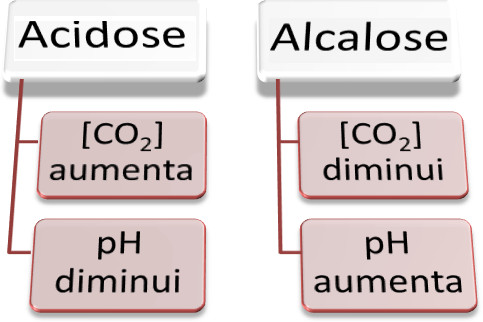
Por exemplo, se a quantidade de HCO3-(aq) aumentar muito em relação a H2CO3(aq), o pH do sangue da pessoa irá subir e teremos um caso de alcalose. Na maioria dos casos, isso se dá em virtude de uma respiração muito rápida, o que diminui a quantidade de CO2 no organismo, deslocando o equilíbrio químico para a esquerda e diminuindo a quantidade de H+(aq) (por isso que o pH aumenta).
Além de crises de ansiedade e histeria, que levam a pessoa a respirar muito, outras causas da hiperventilação que levam à alcalose podem ser: uso de drogas, febre alta, exercícios físicos em excesso, cirroses, overdose de aspirina, doenças pulmonares e, principalmente, no caso de alpinistas, pois a baixa pressão parcial do gás oxigênio na atmosfera em razão da altitude provoca o aumento da ventilação pulmonar e a perda excessiva de CO2.

Os sintomas da alcalose são respiração ofegante, entorpecimento, rigidez muscular e convulsões.
O contrário também pode ocorrer e é até mais comum. Quando o pH do sangue está abaixo da faixa normal, ocorre a acidose. Sua principal causa é a respiração reduzida, o que aumenta a concentração de CO2 no organismo.
Algumas situações que podem levar à acidose respiratória, são elas: asma, pneumonia, enfisema, inalação de fumaça, ingestão de drogas, bronquite, alterações no sistema nervoso central, lesão no sistema respiratório e obstrução das vias aéreas.
Os principais sintomas da acidose são: falta de ar, diminuição ou supressão da respiração, desorientação com possibilidade de coma.
Além da respiratória, existem outros tipos de acidoses, tais como a metabólica e a urêmica.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias


















