Fórmulas dos sais
Os sais são substâncias neutras formadas a partir da ligação do ânion de um ácido, com o cátion de uma base. Dessa forma, para que haja igualdade de cargas positivas e negativas, ao se escrever as fórmulas desses compostos, são necessários índices que indiquem a quantidade correta de ambos os íons. Observe abaixo:
Não pare agora... Tem mais depois da publicidade ;)
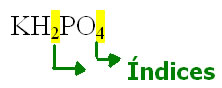
Esses índices são obtidos por meio das cargas dos íons que formam o sal. Uma regra geral para a construção das fórmulas do sal está representada abaixo:

Assim, basta apenas trocar as cargas dos íons; isto é, a carga do ânion vira índice do cátion e vice-versa. Observe como isso é feito abaixo:
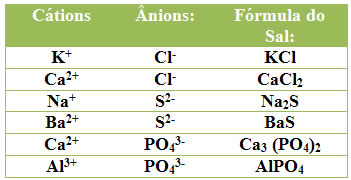
Não pare agora... Tem mais depois da publicidade ;)
Observações importantes:
- Lembre-se que o cátion sempre vem à esquerda na fórmula.
- Note também que não é necessário escrever o índice 1.
- Se os índices forem iguais, como no terceiro exemplo da tabela (Ba2+ e S2-), em que ambas as cargas são 2, é possível simplificar os índices. Por isso, a fórmula deste sal é BaS, e não Ba2S2.

Escrito
por: Jennifer Rocha Vargas Fogaça
Escritor oficial Mundo Educação.
Videoaulas
Artigos Relacionados
Bases no cotidiano
Conheça algumas das principais aplicações e origens das bases usadas no cotidiano.
