Bases no cotidiano
As bases são definidas, segundo a teoria de Arrhenius, como compostos que em meio aquoso sofrem dissociação iônica, liberando como único ânion o hidróxido (OH-). Os compostos básicos podem ser chamados também de alcalinos — palavra que vem do termo árabe al kali, que significa “cinzas”. Isso porque na época as substâncias básicas eram extraídas da queima das plantas.
Isso nos lembra, inclusive, de uma das principais aplicações das bases no cotidiano, que é nos sabões. Os primeiros sabões eram misturas de gorduras de animais (sebo) com as cinzas de madeiras. Para produzir os sabões, era necessário que ocorresse uma reação entre um ácido graxo e uma base. Atualmente, costuma-se reagir óleos ou gorduras com a base hidróxido de sódio (NaOH) sob aquecimento e em meio aquoso, em uma reação chamada de esterificação ou saponificação, na qual se produz o sabão e a glicerina.
Os sabonetes têm um processo de produção semelhante. A principal diferença consiste na utilização de ácidos graxos mais puros. Assim, os sabões e os sabonetes sólidos e líquidos são exemplos de materiais básicos. Isso pode ser visto a seguir: um indicador ácido-base (papel de tornassol) foi colocado no sabonete e ele adquiriu a cor verde. O papel de tornassol adquire cor azul na presença de bases e cor vermelha na presença de ácidos. Então, o fato de ele ter ficado na cor verde indica que o sabonete é alcalino, seu pH fica em torno de 10.
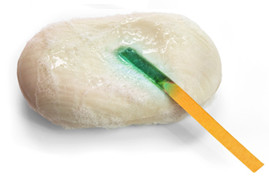
Papel de tornassol em sabonete indicando que ele é básico
O hidróxido de sódio (NaOH) usado na produção dos sabões é uma base forte, pois o seu grau de dissociação é igual a 95% a 18ºC, sendo um composto iônico por natureza. Quanto mais houver íons OH- dissolvidos no meio, mais básica será a solução. Essa base é um sólido branco, cristalino e higroscópico (que absorve água), mais conhecido comercialmente como soda cáustica, pois ela é corrosiva, podendo causar sérias queimaduras na pele.
A soda cáustica é muito utilizada no cotidiano para remoção de sujeiras pesadas. Na indústria, ela é usada na produção de tecidos, papel e produtos de uso doméstico.
Já deu para perceber que as bases são muito comuns em produtos de limpeza, não é mesmo?! Mas não é só em virtude da soda cáustica. Outra base presente nesses materiais é o hidróxido de amônio (NH4OH), que, na realidade, é a solução aquosa de amônia (NH3(g) + H2O(l) → NH+4(aq)+ OH-).
Além de ser usada em produtos de limpeza, essa solução, conhecida como amoníaco, é usada também para descolorir cabelos e pelos do corpo. A solução de amoníaco para uso doméstico possui pH em torno de 11 e a de uso farmacêutico tem o pH em torno de 12.

Alguns produtos de limpeza doméstica possuem hidróxido de amônio em sua composição
A amônia também é utilizada na produção de fertilizantes que ajudam a melhorar a produção agrícola. Falando em métodos de desenvolvimento da agricultura, outra base usada com essa finalidade é o hidróxido de cálcio, Ca(OH)2. Depois de aquecido, ela gera o óxido de cálcio (cal) que é usado na calagem para corrigir a acidez do solo.
Essa mesma base é conhecida como água de cal e é usada também na produção de argamassa e na caiação de paredes e árvores, com a principal finalidade de repelir insetos, preservar a vedação e evitar a infiltração da água.

Caiação de árvore para repelir insetos
As bases também estão presentes nos antiácidos estomacais, como o leite de magnésia (contém hidróxido de magnésio – Mg(OH)2). Alguns sais que em solução aquosa formam bases fracas também são usados para combater a acidez estomacal. Um exemplo é o hidrogenocarbonato de sódio, conhecido comercialmente como bicarbonato de sódio (NaHCO3).
Em meio aquoso, esse sal libera os íons Na+ e HCO3-. O ânion HCO3- reage com o cátion H+ da água, formando um ácido forte, o ácido carbônico H2CO3. Mas o cátion Na+ do sal não reage com o ânion OH- da água, porque senão formaria uma base forte, que é o hidróxido de sódio, NaOH. Visto que ela é uma base forte, os ânions OH- ficam livres, dissociados no meio, tornando a solução básica (pH > 7). Mais detalhes sobre sais que reagem com água e tornam o meio básico podem ser vistos no texto Hidrólise salina.
Desse modo, o bicarbonato de sódio pode ser utilizado como antiácido. Mas o seu uso muito prolongado pode destruir o equilíbrio ácido-base do estômago, podendo causar alcalose metabólica. Por isso, sempre consulte um médico antes de usar qualquer medicamento.
Por fim, existem também alguns alimentos que são alcalinos, como alguns frutos adstringentes (que “amarram a boca”), tais como bananas e caquis verdes, além do caju.

Alimentos alcalinos - bananas, cajus e caquis verdes

