Grau de Equilíbrio
O grau de equilíbrio, simbolizado por “α”, é usado em equilíbrios químicos para indicar a relação entre a quantidade de matéria (número de mol) depois que determinado reagente foi consumido e a quantidade de matéria inicial.
Assim, o grau de equilíbrio pode ser calculado por meio da seguinte expressão:
α = número de mol consumido
número de mol inicial
Veja um exemplo:
“Considere que em um recipiente fechado, com capacidade de 1 L, à temperatura de 100ºC, há 10 mol de C2H4 e 10 mol de Cl2. Começa a ocorrer a seguinte reação reversível: C2H4+ Cl2 ↔ C2H4Cl2. Após certo tempo, verificou-se que a reação atingiu o equilíbrio químico e que quatro mol de C2H4Cl2 formaram-se. Qual é o valor do grau de equilíbrio dos reagentes?”
Resolução:
Os dados fornecidos no enunciado estão na tabela a seguir para melhor visualização:
.jpg)
Tabela para organizar os dados usados no cálculo do grau de equilíbrio
Com esses dados, basta substituir os valores na expressão do grau de equilíbrio:
α = número de mol consumido
número de mol inicial
α = 4 mol
10 mol
α = 0,4
O valor do grau de equilíbrio pode variar somente entre 0 e 1, portanto, podemos expressar essa grandeza também em porcentagem, sendo que, nesse exemplo, temos: α = 40%.
É muito importante não confundir o grau de equilíbrio (α) com a constante de equilíbrio (Kc). Quando ocorre uma perturbação no sistema em equilíbrio, como uma variação da concentração dos reagentes ou dos produtos ou da temperatura do sistema, o grau de equilíbrio sofrerá variações também. Já a constante de equilíbrio variará somente com uma variação da temperatura.
Mas o grau de equilíbrio pode nos ajudar a resolver problemas envolvendo o cálculo de Kc. Veja:
Exemplo: Em uma temperatura T, 2 mol de NH3 estão 20% dissociados em N2 e H2. Sabendo que o volume do recipiente é de 5 L, determine o valor de Kc para o equilíbrio:
2 NH3 ↔N2 + 3 H2
Resolução:
A questão fornece o grau de equilíbrio, isto é, a porcentagem de NH3 que reage:
-reagem = 20% de 2 mol = 0,2 (2 mol) e 0,4 mol;
-restam no equilíbrio: 2 – 0,4 = 1,6 mol.
Assim, temos:
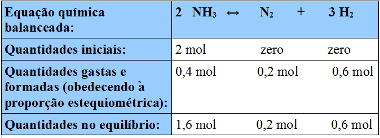
Tabela para organizar os dados de exemplo de cálculo do grau de equilíbrio
Com esses dados, calculamos as concentrações de cada substância:
[NH3] = 1,6 mol = 0,32 mol/L
5 L
[N2] = 0,2 mol = 0,04 mol/L
5 L
[H2] = 0,6 mol = 0,12 mol/L
5 L
Agora basta aplicar na expressão de Kc:
Kc = [N2] . [H2]3
[NH3]2
Kc = 0,04 . (0,12)3
(0,32)2
Kc = 0,04 . 0,001728
0,1024
Kc = 0,000675 ou 6,75 . 10-4
É interessante notar que, dependendo do tipo de reação que estamos trabalhando, o nome do grau de equilíbrio pode mudar. Por exemplo, se a reação for de decomposição, nesse caso, teremos o grau de decomposição; se for uma reação de ionização, o grau será de ionização e assim por diante. Outros exemplos são: grau de dissociação, grau de hidrólise, grau de precipitação, entre outros.
Inclusive o grau de dissociação e de ionização servem para verificar a força dos ácidos e das bases, Força ácida e Classificação das bases.

