Influência dos catalisadores na velocidade das reações


Isso significa que ao final do processo, os catalisadores são totalmente reconstituídos, tanto a sua massa, quanto sua composição.
Um exemplo de catalisador é uma enzima presente no sangue, e também na batata, denominada catalase. Essa enzima acelera o processo de decomposição do peróxido de hidrogênio (H2O2), que é considerado muito lento em condições normais. Assim, quando adicionamos gotas de sangue ou uma batata ao peróxido de hidrogênio, essa reação se processa rapidamente. É por isso que quando nos machucamos e colocamos água oxigenada é observado um “aborbulhamento”.
Toda reação química possui uma energia de ativação, ou seja, uma quantidade de energia mínima para que ela tenha um início. Essa energia é necessária para se formar o complexo ativado, que é o estado intermediário formado entre os reagentes e os produtos, em cuja estrutura as ligações dos reagentes estão sendo enfraquecidas e as ligações dos produtos estão sendo formadas.
A seguir temos uma visualização gráfica do complexo ativado e da energia de ativação em uma reação qualquer:
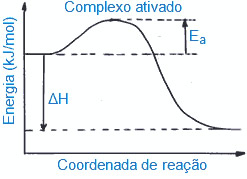
O valor da energia de ativação varia de uma reação química para outra. Assim, quanto maior for a energia de ativação, maior será o tempo para que a reação ocorra.
No caso da reação de decomposição do peróxido de hidrogênio, a sua energia de ativação é muito elevada: 76 kJ/mol, por isso a reação se dá de forma lenta. A energia de ativação alta se torna um obstáculo para a formação do complexo ativado.
Quando se adiciona o catalisador a essa reação, ela se processa mais rápido porque o catalisador muda o mecanismo da reação ou o caminho através do qual os reagentes se transformam nos produtos. Isso se dá porque esse caminho alternativo exige menor energia de ativação e, consequentemente, com uma energia de ativação menor, a reação se processará de forma mais rápida.
Para entender como isso se dá, considere a reação genérica a seguir, na qual A e B são os reagentes, C é o catalisador e AB é o produto que se quer obter. A reação genérica se dá da seguinte forma:
A + B → AB
Agora veja como se dá a participação do catalisador (C) nessa reação:
1ª etapa – Lenta, pois há a formação do complexo ativado. Essa é a etapa determinante da reação:
A + C → AC
Complexo
ativado
2ª etapa – Rápida:
AC + B → AB + C
Observe que a soma das duas etapas é exatamente igual à reação genérica, o que significa que o catalisador não participa como um produto da reação, sendo regenerado no final.
A ação do catalisador sobre a energia de ativação (Ea) pode ser vista pelo gráfico a seguir:

Veja no gráfico que o catalisador não altera a variação da entalpia da reação (?H), nem aumenta o rendimento da reação, somente sua rapidez.
Outros pontos importantes sobre a ação do catalisador: ele não faz com que dois ou mais reagentes que não tenham afinidade química reajam, ele só atua sobre compostos que reagem entre si em condições normais; e se a reação for reversível, o catalisador aumentará a rapidez da taxa de desenvolvimento tanto da reação direta como da inversa.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















