Catálise Heterogênea
A catálise é um processo no qual se utiliza o catalisador para acelerar a velocidade de uma reação química. Os catalisadores, por sua vez, são substâncias que realizam esse aumento na velocidade, porém sem interferir no resultado final da reação – eles não participam do processo reagindo nem formando um produto, pois ao final da reação são reestabelecidos. Portanto, a massa do catalisador não é consumida durante o processo.
Dependendo do sistema, a catálise pode ser classificada em dois tipos: homogênea e heterogênea. Se desejar compreender mais sobre a catálise homogênea, você pode ler o texto “Catálise Homogênea” nesta mesma seção de Química. A seguir trataremos apenas da catálise heterogênea:

Ao contrário da catálise homogênea, na qual o catalisador e os reagentes precisam estar no mesmo estado físico; na catálise heterogênea normalmente o catalisador está em um estado físico diferente dos reagentes. Temos alguns exemplos a seguir:
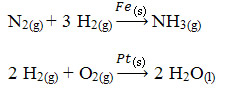
Observe que nos dois casos acima os catalisadores estão no estado sólido; enquanto que os reagentes estão no estado gasoso. Isso se dá porque o catalisador adsorve as moléculas dos reagentes, enfraquecendo as suas ligações e diminuindo a energia de ativação. Dessa forma, a reação se processa mais rapidamente.
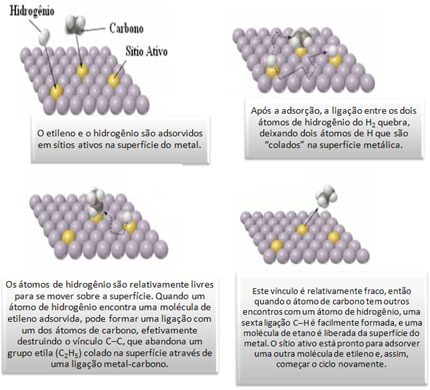
Para visualizarmos isso, consideremos a reação exotérmica do gás hidrogênio com gás etileno para formar gás etano:
C2H4(g) + H2(g) → C2H6(g)
Essa reação se processa muito lentamente sem a presença de um catalisador. Mas na presença de um metal em pó fino (como níquel, paládio, ou platina), a reação ocorre com bastante facilidade, à temperatura ambiente. O mecanismo pelo qual ocorre a reação é mostrado esquematicamente na figura abaixo:
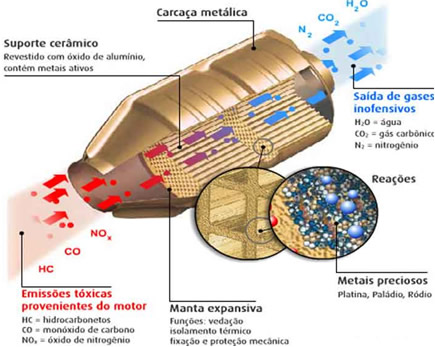
Um exemplo de catálise heterogênea que é bastante comum em nosso cotidiano é a que ocorre em conversores catalíticos dos carros, também denominados catalisadores. Sua finalidade é adsorver os gases poluentes nocivos que resultam da combustão incompleta da gasolina, do álcool e do óleo diesel, como o monóxido de carbono (CO), hidrocarbonetos e óxidos de nitrogênio. Esses gases são então transformados em gases não tóxicos, como CO2, N2, O2 e H2O.
Observe o esquema de funcionamento desses catalisadores: