Curvas de solubilidade
O aumento da temperatura influencia na solubilidade dos solutos em determinada quantidade de solvente.
Por exemplo, se colocarmos certa quantidade de açúcar na água e parte dele não se dissolver, teremos uma solução saturada com corpo de fundo. No entanto, se levarmos essa solução para o aquecimento, veremos que o corpo de fundo irá se dissolver. Isso significa que a solubilidade do açúcar é aumentada com a elevação da temperatura.
Para a maioria das substâncias, um aumento da temperatura provoca um aumento na solubilidade. Abaixo temos uma tabela que relaciona a solubilidade do cloreto de amônio (NH4Cl) em 100 g de água em diferentes temperaturas:
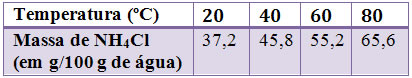
Essa tabela nos mostra a máxima quantidade possível de soluto que se pode dissolver, ou seja, o seu coeficiente de solubilidade, em 100 g de água, a cada uma dessas temperaturas. A 20ºC a quantidade máxima de NH4Cl que se dissolve em 100 g de água é 37,2 g, originando uma solução saturada.
Note que com o aumento da temperatura, a massa de NH4Cl que se dissolve também aumenta. Assim, esses dados podem ser transpostos para um gráfico que mostra a curva de solubilidade do NH4Cl:
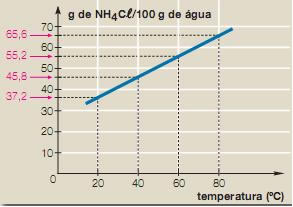
A curva ascendente mostra que a solubilidade realmente aumenta com a elevação da temperatura.
Entretanto, existem casos em que a solubilidade do soluto diminui com o aumento da temperatura. Como ocorre com Na2SO4, mostrado no gráfico abaixo, cuja curva de solubilidade é descendente.
Outro caso que pode ser também visto no gráfico, é o do cloreto de sódio (NaCl – sal de cozinha). A elevação da temperatura praticamente não altera a sua solubilidade.
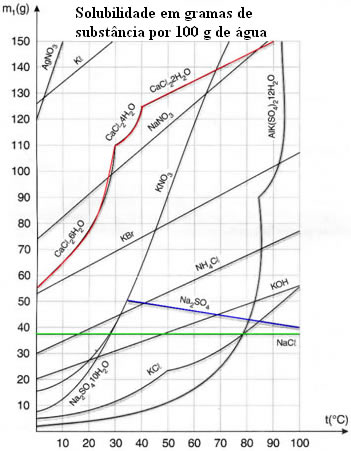
Observe agora o Na2SO4: ele se torna mais solúvel com o aumento da temperatura até certo ponto, a partir do qual a solubilidade começa a diminuir.
Agora, um caso especial que não se pode deixar de mencionar ocorre quanto à solubilidade de sais hidratados, ou seja, sais que contêm na sua constituição um determinado número de moléculas de água agregadas. Um exemplo representado no gráfico acima é o do cloreto de cálcio hexa-hidratado (CaCl2 . 6 H2O). Nesse caso, na medida em que se aumenta a temperatura e esse sal vai se dissolvendo na água, ele vai sofrendo uma alteração no número de moléculas de água de cristalização, o que faz com que haja alterações na sua solubilidade. No gráfico, podemos observar isso por meio de inflexões na sua curva de solubilidade.
Isso tudo nos mostra que substâncias diferentes apresentam curvas de solubilidade diferentes.

