Lei de conservação da massa
Em 1773, o famoso cientista Antoine Laurent de Lavoisier (1743-1794) realizou repetidamente um experimento de calcinar metais em recipientes fechados. Lavoisier é considerado o “pai” da Química Moderna porque nestes e em outros dos seus experimentos ele utilizou importantes técnicas experimentais, tais como a utilização de balanças com alta precisão para a época, realizou as reações em recipientes fechados e anotou cuidadosamente todos os dados coletados, como a massa dos reagentes e a dos produtos.
Esses mesmos experimentos foram realizados em 1760 pelo químico russo Mikhail Vasilyevich Lomonosov (1711-1775) e ele enunciou a lei de conservação da massa que explicaremos melhor adiante. No entanto, os trabalhos deste cientista não tiveram impacto porque não foram divulgados pela Europa. Coube a Lavoisier o registro, explicação e divulgação dessa lei, que hoje é também conhecida como lei de Lavoisier.
Lavoisier aqueceu o mercúrio metálico numa retorta com a boca dentro de uma retorta contendo ar e mergulhada numa cuba com mercúrio. Depois do aquecimento, o volume do ar na retorta diminuiu, pois o volume do mercúrio na cuba subiu pela redoma. Isso significa que o mercúrio reagiu com “algo” no ar, que hoje sabemos que é o oxigênio. O produto formado foi o óxido de mercúrio II, um pó vermelho que aderiu às paredes da retorta.
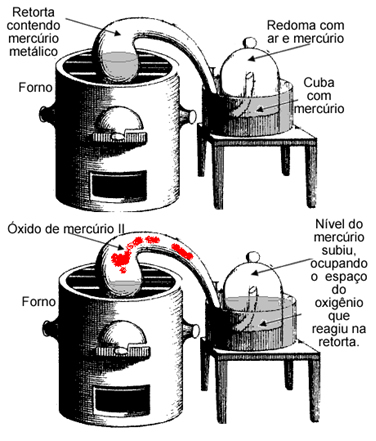
Pesando o sistema inicial (mercúrio metálico + oxigênio) e o sistema final (óxido de mercúrio II), Lavoisier percebeu que a massa total dos reagentes era igual à massa total dos produtos.
Ele repetiu esse experimento queimando outros materiais e percebeu que a massa dos sistemas permanecia constante em todos os casos. Veja os exemplos abaixo:
Grafite + oxigênio → gás carbônico
3 g + 8 g = 11 g
Mercúrio metálico + oxigênio → óxido de mercúrio
100,5 g + 8 g = 1 08,5 g
Água → hidrogênio + oxigênio
9 g = 1 g + 8 g
Calcário → cal viva + gás carbônico
100 g = 56 g 44 g
Com isso, ele enunciou a Lei de Conservação da Massa da seguinte forma:
“No interior de um recipiente fechado, a massa total não varia, quaisquer que sejam as transformações que venham a ocorrer.”
Ou
“Num recipiente fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos.”
Atualmente, essa lei é mais conhecida pelo seguinte enunciado:
“Na natureza, nada se perde, nada se cria, tudo se transforma.”

