Ligação pi
Desde o 7º ano o estudante sabe que o seu organismo necessita de várias substâncias importantes, como a água (H2O), o gás oxigênio (O2) e a glicose (C6H12O6). Todas essas substâncias são formadas por ametais com ou sem a presença de hidrogênio, por isso, são chamadas de moleculares.
Substância molecular é aquela em que seus átomos atingem o octeto por intermédio de uma ligação química chamada de covalente ou molecular, na qual temos um compartilhamento de elétrons entre os átomos envolvidos (todos com tendência de ganhar elétrons). Essa ligação pode ser representada de três formas e por dois nomes:
-
Ligação simples: – (sigma)
-
Ligação dupla: = (1 sigma e 1 pi)
-
Ligação tripla: ≡ (1 sigma e 2 pi)
A ligação sigma está presente em todas as ligações covalentes, mas a ligação pi somente ocorre nos casos de dupla ou tripla ligação. Na ligação pi, temos a interpenetração dos orbitais atômicos incompletos no eixo paralelo. Por essa razão, ela só ocorre entre orbitais do tipo p. Dos três orbitais p, dois podem realizar ligação pi, o vertical e o diagonal. O horizontal é utilizado para representar a ocorrência da ligação sigma. Isso acontece porque apenas esse dois eixos podem ficar em paralelo com os mesmos eixos de outro átomo. Veja um modelo:

Representação esquemática dos orbitais de um átomo de nitrogênio
Sempre que a ligação pi aparecer em uma fórmula estrutural, já está subentendido que a interpenetração no eixo paralelo está acontecendo. Veja exemplos a seguir:
1º Exemplo: O2
O=O
O oxigênio apresenta número atômico 8 e tem a seguinte distribuição eletrônica:
1s2
2s2 2p4
Por isso, esse elemento apresenta dois orbitais p incompletos: um deles para realizar a ligação sigma (no mesmo eixo) e o outro, a pi (eixo paralelo). A seguir temos a representação dos orbitais p do oxigênio e o desenho que os representa:

Representação didática dos orbitais de um átomo de oxigênio
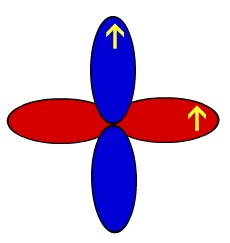
Representação esquemática dos orbitais de um átomo de oxigênio
O arco representado por cor diferente representa a interpenetração desses orbitais no eixo paralelo, ou seja, a ligação pi.
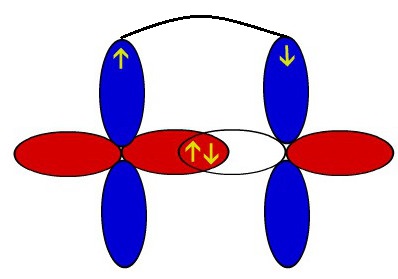
Representação esquemática dos orbitais de dois átomos de oxigênio interpenetrando-se
2º exemplo: N2
N≡N
O N apresenta número atômico 7 e tem a seguinte distribuição eletrônica:
1s2
2s2 2p3
Por isso, esse elemento apresenta três orbitais p incompletos. Um deles realiza a ligação sigma (no mesmo eixo) e os outros dois, as duas pi. A seguir temos a representação dos orbitais p do nitrogênio e o desenho que os representa:

Representação didática dos orbitais de um átomo de nitrogênio
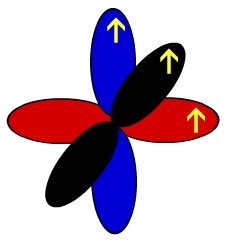
Representação esquemática dos orbitais de um átomo de nitrogênio
Os arcos representados de cores diferentes representam a interpenetração desses orbitais no eixo paralelo, ou seja, a ligação pi.
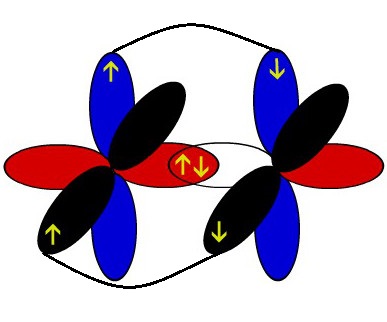
Representação esquemática dos orbitais de dois átomos de nitrogênio interpenetrando-se

