Ligação covalente
A ligação covalente é uma das maneiras pelas quais os átomos se unem para formar ligações químicas. A ligação covalente se estabelece pelo compartilhamento dos elétrons de valência entre dois átomos, para que ambos atinjam uma condição de estabilidade.
A ligação covalente normalmente se estabelece entre elementos não metálicos, e entre estes e o hidrogênio, sendo também conhecida como ligação molecular. Dependendo da quantidade de pares de elétrons compartilhados entre dois átomos, formam-se ligações simples, duplas ou triplas por meio do estabelecimento de ligações covalentes do tipo sigma (σ) e/ou pi (π).
Leia também: Distribuição eletrônica — a organização dos elétrons ao redor do núcleo do átomo
Resumo sobre ligação covalente
-
Ligações covalentes são ligações químicas formadas pelo compartilhamento de elétrons de valência entre dois átomos.
-
O par de elétrons compartilhado pertence aos dois átomos.
-
A ligação covalente ocorre para que cada átomo atinja sua estabilidade, com presença de oito elétrons em sua camada de valência.
-
O hidrogênio e átomos não metálicos participam das ligações covalentes.
-
Elas podem ser polares ou apolares, dependendo da eletronegatividade dos átomos envolvidos.
-
Átomos podem compartilhar um, dois ou três pares de elétrons, formando ligações simples, duplas ou triplas respectivamente.
-
As ligações covalentes são formadas por ligações do tipo sigma e/ou pi.
-
Enquanto na ligação covalente os elétrons são compartilhados por dois átomos, na ligação iônica os elétrons são doados ou recebidos, e, na ligação metálica, os elétrons ficam deslocalizados ao longo da estrutura.
Videoaula sobre ligação covalente
O que é ligação covalente?
A ligação covalente é o tipo de ligação química estabelecida via compartilhamento de um ou mais pares de elétrons entre dois átomos, de modo que ambos atinjam a estabilidade. Na ligação covalente, os dois átomos compartilham igualmente os elétrons, não havendo processo de doação ou recebimento de elétrons entre eles.
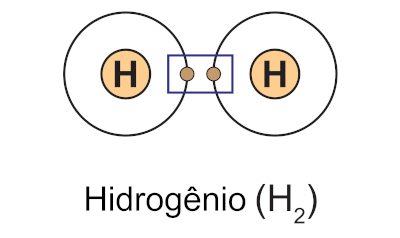
A ligação covalente também é conhecida como ligação molecular, pois é esse tipo de ligação química que ocorre em moléculas estáveis (neutras).
Veja alguns exemplos de ocorrência de ligação covalente:
-
Ácido clorídrico (HCl): essa molécula é formada pelo compartilhamento de elétrons de valência entre o átomo de hidrogênio e o átomo de cloro. O traço representa a ligação covalente.
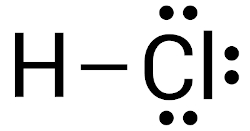
-
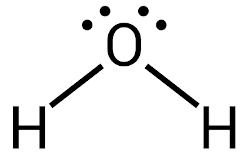
Água (H2O): na molécula de água, existem ligações covalentes entre o oxigênio e o hidrogênio. Os traços representam ligações covalentes.
-
Gás oxigênio (O2): na molécula de gás oxigênio, há o compartilhamento de dois pares de elétrons entre os dois átomos, formando-se uma ligação dupla.
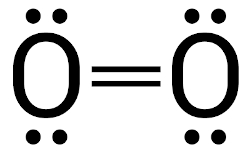
-
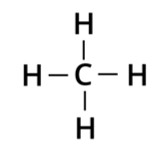
Metano (CH4): na molécula de metano, cada átomo de hidrogênio compartilha um par de elétrons com o carbono. Dessa forma, o carbono estabelece quatro ligações covalentes.
Características da ligação covalente
Os átomos envolvidos em ligações covalentes são sempre aqueles que precisam receber elétrons para atingir sua estabilidade. Normalmente, são os elementos não metálicos que se combinam para formar ligações covalentes, entre eles mesmos ou com o hidrogênio.
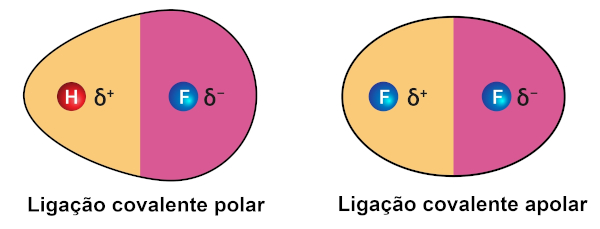
As ligações covalentes podem se estabelecer entre átomos de igual eletronegatividade ou de valores muito próximos, formando uma ligação covalente apolar, em que o par de elétrons está igualmente distribuído entre os dois átomos. Os hidrocarbonetos são formados por ligações covalentes polares, assim como as moléculas diatômicas (O2, F2, He2, H2).
Esse tipo de ligação também se estabelece entre elementos com diferentes eletronegatividades. Lembrando que a eletronegatividade é a propriedade de um átomo atrair elétrons para si. Nesse caso, o par de elétrons fica deslocado no sentido do átomo de maior eletronegatividade, originando uma ligação polarizada. Isso ocorre na molécula de ácido clorídrico, por exemplo, na qual os elétrons ficam mais próximos ao cloro, em razão de sua maior eletronegatividade.
De modo geral, os compostos moleculares, formados por ligações covalentes, têm pontos de fusão e de ebulição mais baixos do que os compostos iônicos. Os compostos covalentes não têm capacidade de conduzir corrente elétrica.
Como ocorre a ligação covalente?
Os átomos se combinam com a intenção de alcançar uma condição de estabilidade energética. Essa combinação pode acontecer de diferentes formas, e uma das formas de combinação dos átomos é pelo estabelecimento de ligações covalentes.
Uma maneira de entender a estabilidade dos átomos é por meio da teoria do octeto, que defende que um átomo está estável ao possuir oito elétrons em sua camada de valência. Condição conhecida como “configuração de gás nobre”, uma vez que esses elementos do grupo 18 possuem sua valência completa e são muito pouco reativos (estáveis).
Assim, a formação da ligação covalente é uma forma de alguns átomos alcançarem tal configuração. Por isso, espécies com cinco, seis e sete elétrons na camada de valência têm forte tendência a compartilhar elétrons, buscando completar seu octeto e, consequentemente, alcançar estabilidade.
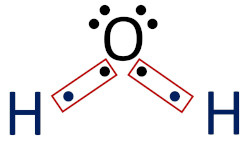
A ilustração abaixo representa a formação das ligações covalentes da molécula de água. O oxigênio, inicialmente, possui seis elétrons de valência, bastando apenas dois elétrons para que ele alcance a estabilidade.
Os átomos de hidrogênio, como têm apenas a primeira camada eletrônica, atingem a estabilidade com apenas dois elétrons de valência, porém os átomos de hidrogênio naturalmente têm apenas um elétron.
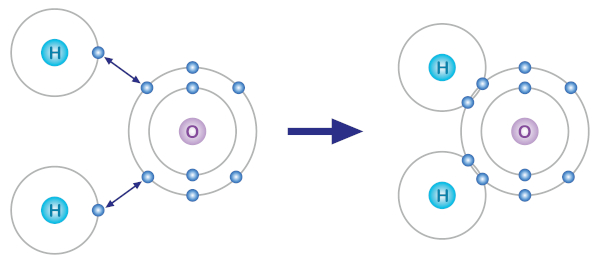
O compartilhamento de elétrons entre os átomos de hidrogênio e de oxigênio, para a formação da molécula de água, é favorável às duas espécies, pois ambas alcançam a sua condição de estabilidade. Note que o oxigênio agora passa a ter oito elétrons, e os átomos de hidrogênio agora contam com dois elétrons de valência.
Uma forma didática de representar os elétrons de valência e a formação das ligações covalente é usando a fórmula eletrônica de Lewis. Nesse formato, os elétrons de valência são representados por pontos ao redor do átomo e se torna fácil identificar a quantidade de elétrons que precisa ser compartilhada para atingir a estabilidade. As ligações covalentes são destacadas por marcações apontando o compartilhamento de elétrons. Veja:
Saiba mais: Exceções à teoria do octeto — quais são os aspectos relacionados?
Tipos de ligação covalente
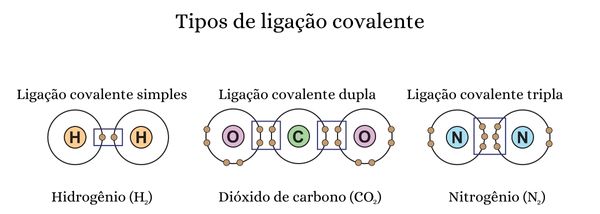
Os tipos de ligação covalente se referem à forma como os elétrons são compartilhados.
-
Ligações covalentes simples: há o compartilhamento de um único par de elétrons, originando uma única ligação, chamada de ligação simples.
-
Ligações covalente duplas: são formadas quando dois elementos compartilham dois pares de elétrons, originando duas ligações covalentes, representadas por dois traços.
-
Ligações covalentes triplas: nelas se estabelece o compartilhamento de três pares de elétrons entre os átomos, e são representadas por três traços entre os dois átomos.
As ligações simples, duplas e triplas se assemelham por serem constituídas por uma única ligação sigma (σ). A ligação sigma se estabelece na interpenetração de nuvens eletrônicas no mesmo eixo, formando um ambiente propício para o compartilhamento de elétrons. Isso pode acontecer entre dois orbitais s, entre dois orbitais p ou, ainda, entre um orbital s e um orbital p.
As ligações sigma fazem parte de todas as ligações covalentes. Já no caso de ligações múltiplas (ligações duplas e triplas), além da ligação sigma, existe a ligação pi (π). As ligações π se formam pela interpenetração de orbitais p paralelos, ou seja, que estejam lado a lado.
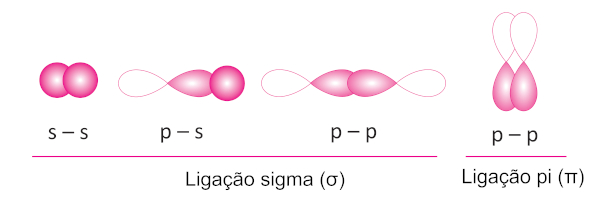
Portanto, ligações σ e π são formas de as ligações covalente acontecerem, sendo:
-
Ligações simples (–): formadas apenas por uma ligação σ.
-
Ligações duplas (=): formadas por uma ligação σ e uma ligação π.
-
Ligações triplas (≡): formadas por uma ligação σ e duas ligações π.
Por fim, a ligação covalente coordenada ou dativa é o caso em que um mesmo átomo fornece o par de elétrons para o estabelecimento da ligação covalente. Na realidade, essa divisão é apenas didática, pois, na prática, a ligação covalente coordenada possui as mesmas força e características das ligações covalentes polares convencionais.
Veja também: Carbono quiral — o carbono que estabelece apenas ligações simples com quatro ligantes diferentes
Diferenças entre ligação covalente, ligação iônica e ligação metálica
Os compostos químicos se formam por meio de ligações químicas, que podem ser covalentes, iônicas ou metálicas, a depender das características dos átomos envolvidos.
-
Ligação covalente: é formada pelo compartilhamento de, ao menos, um par de elétrons entre dois átomos para que ambos atinjam a estabilidade (teoria do octeto), sendo os elétrons igualmente distribuídos entre eles.
-
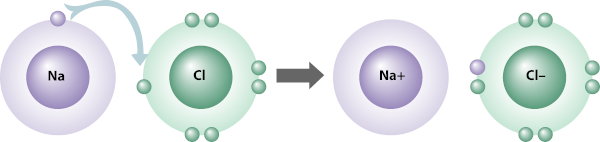
Ligação iônica: ocorre pela doação/recebimento de elétrons entre átomos, para que ambos atinjam a estabilidade. Uma das espécies doa elétrons da sua camada de valência para que fique com a valência completa, enquanto a outra aceita esses elétrons para completar a sua própria valência.
-
Ligação metálica: é formada entre metais e se baseia na teoria do “mar de elétrons”. Os metais possuem elétrons de valência mais distantes do núcleo, sendo essas espécies não tão fortemente “presas” a ele (baixa energia de ionização). Assim, na ligação metálica, há a liberação parcial de elétrons mais externos, acompanhada da formação de cátions metálicos. As cargas positivas dos cátions são estabilizadas pelas cargas negativas dos elétrons. Os elétrons têm liberdade de movimentação suficiente para transitar ao longo da estrutura metálica, caracterizando o mar de elétrons, que contribui para a estabilidade dos íons formados.
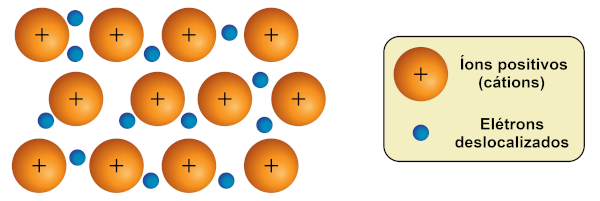
Portanto, na ligação covalente, os elétrons são compartilhados por dois átomos; na ligação iônica, os elétrons são doados ou recebidos; e, na ligação metálica, os elétrons ficam deslocalizados ao longo da estrutura.
Exercícios resolvidos sobre ligação covalente
Questão 1
(UEPG) Quando uma reação química ocorre entre dois átomos, os seus elétrons de valência são rearranjados de tal forma que uma força resultante atrativa passa a existir entre eles. Esta força atrativa é a chamada ligação química. Sobre as ligações químicas, assinale o que for correto:
A) Em uma molécula de HCl, o par de elétrons compartilhado na ligação encontra-se mais próximo do átomo de cloro, devido a sua maior eletronegatividade, o que caracteriza uma ligação apolar.
B) A ligação covalente se caracteriza pelo compartilhamento de elétrons de valência entre os átomos que participam da ligação.
C) Ligações duplas e triplas não são formadas por compartilhamento de elétrons,
D) Uma ligação metálica se forma quando um ou mais elétrons de valência são transferidos de um átomo para outro, dando origem a íons positivos e negativos.
E) Ligações covalentes do tipo sigma (σ) somente ocorrem entre orbitais do tipo p de um átomo e do tipo s de outro átomo.
Resolução:
Alternativa B
O item A é incorreto apenas sobre afirmar que na molécula de HCl a ligação é apolar. Como o cloro é muito mais eletronegativo do que o hidrogênio, a ligação é polar.
O item C é incorreto, pois as ligações duplas e triplas são tipos de ligações covalentes (compartilhamento de elétrons).
O item D é incorreto, porque a ligação metálica é formada por elétrons que se mantêm deslocalizados em torno da estrutura formada por cátions metálicos.
O item E é incorreto porque ligações sigma ocorrem entre orbitais s, orbitais p e pela combinação de orbitais p e s, sendo a condição necessária que esse orbitais se encontrem no mesmo eixo internuclear.
Questão 2
(UFJF) Nos pântanos e cemitérios, é comum ocorrer a formação de gás metano (CH4), proveniente da decomposição de matéria orgânica. O metano pode reagir com o oxigênio do ar espontaneamente e formar luzes bruxuleantes, conhecidas como fogo-fátuo. Assinale a alternativa CORRETA.
A) O CH4 é uma substância composta que contém ligações iônicas, e o oxigênio do ar é uma substância composta que contém ligações covalentes polares.
B) O CH4 é uma substância composta que contém ligações covalentes, e o oxigênio do ar é uma substância simples que contém ligações covalentes apolares.
C) O CH4 é uma substância simples que contém ligações iônicas, e o oxigênio do ar é uma substância simples que contém ligações covalentes polares.
D) O CH4 é uma substância composta que contém ligações covalentes, e o oxigênio do ar é uma substância composta que contém ligações covalentes polares.
Resolução:
Alternativa B
O CH4 é uma substância composta (porque é formada por dois elementos) e estabelece ligações covalentes (compartilhamento de elétrons) porque carbono e hidrogênio são elementos não metálicos e possuem eletronegatividades similares.
O oxigênio do ar (O2) é uma substância simples (formada apenas por um elemento químico) que estabelece ligações covalente apolares, uma vez que ambos os átomos atraem os elétrons com a mesma intensidade (mesma eletronegatividade).