Regra do octeto
A regra do octeto é um princípio fundamental na química que explica como os átomos interagem para alcançar uma configuração estável, semelhante à dos gases nobres. Proposta inicialmente por Gilbert Lewis em 1916, a regra do octeto afirma que os átomos tendem a ganhar, perder ou compartilhar elétrons para completar sua camada de valência com oito elétrons, alcançando assim uma configuração mais estável.
Essa regra é especialmente útil para entender as ligações covalentes e iônicas, essenciais na formação de moléculas e compostos. Ao compreender a regra do octeto, é possível explicar o comportamento de diversos elementos químicos e prever como eles se combinam para formar substâncias estáveis.
Leia também: Qual é a estrutura do átomo?
Resumo sobre a regra do octeto
- De acordo com a regra do octeto, átomos se combinam entre si para alcançar a estabilidade de um gás nobre, apresentando oito elétrons na camada mais externa.
- Alguns átomos podem alcançar a estabilidade formando íons, ao perder ou ganhar elétrons, e através de ligações covalentes.
- Alguns átomos podem apresentar octeto reduzido (menos de oito elétrons na camada de valência) ou octeto expandido (menos de oito elétrons na camada de valência).
- Os gases nobres são inertes devido à presença de oito elétrons na sua camada de valência.
- Alguns átomos conseguem alcançar a estabilidade com apenas dois elétrons na camada mais externa, é o caso do hidrogênio, lítio e berílio.
Videoaula sobre a regra do octeto
O que diz a regra do octeto?
A regra do octeto estabelece que os átomos buscam adquirir uma configuração eletrônica estável semelhante à dos gases nobres, que possuem oito elétrons na camada de valência, exceto o hélio, que possui apenas dois. Esse comportamento foi observado por Gilbert Lewis, que percebeu que a estabilidade química dos gases nobres estava relacionada à sua configuração eletrônica completa na camada mais externa.
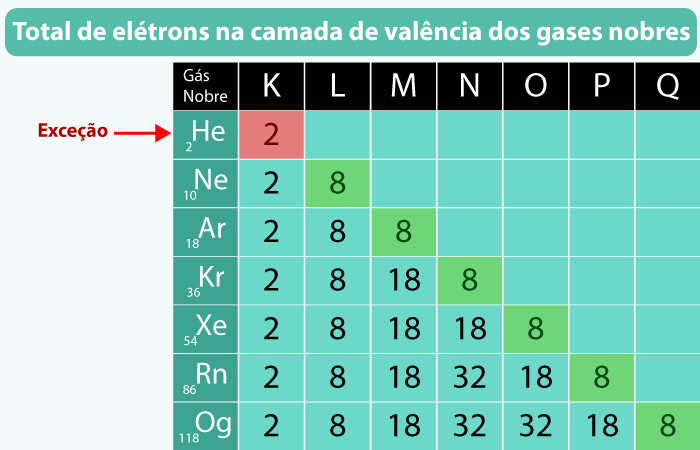
Lewis observou que elementos com camadas de valência incompletas tendem a reagir com outros átomos para preencher esses níveis, buscando completar o "octeto" de oito elétrons. Isso pode ocorrer de diferentes maneiras: por meio da perda ou ganho de elétrons, o que forma íons e leva à criação de ligações iônicas, ou pelo compartilhamento de elétrons, resultando em ligações covalentes.
O conceito de "estabilidade" dos átomos está diretamente relacionado à baixa energia necessária para manter a configuração completa na camada de valência. Como exemplo, o átomo de oxigênio (O), com número atômico 8, possui a configuração eletrônica 1s² 2s² 2p⁴. Para atingir o octeto, ele precisa ganhar dois elétrons, formando a configuração estável 1s² 2s² 2p⁶, similar ao gás nobre neônio (Ne).
Os gases nobres são a chave para entender a regra do octeto, pois já possuem sua camada de valência completa. Esses elementos, como o neônio (Ne) e o argônio (Ar), são inertes e não tendem a formar compostos com facilidade, já que não precisam ganhar, perder ou compartilhar elétrons para alcançar estabilidade. Por meio dessa observação, a regra do octeto se torna uma base para prever e explicar as reações químicas entre outros elementos da tabela periódica.
Como funciona a regra do octeto?
A estabilidade prevista pela regra do octeto pode ser alcançada de duas maneiras principais: através da perda ou ganho de elétrons (formando íons), ou pelo compartilhamento de elétrons (formando moléculas covalentes).
Por exemplo, o átomo de sódio (Na), que possui número atômico 11 e a configuração eletrônica 1s² 2s² 2p⁶ 3s¹, tende a perder um elétron para se estabilizar. Ao perder esse elétron, ele atinge a configuração eletrônica do gás nobre neônio (Ne), tornando-se um íon positivo (Na⁺), com a distribuição eletrônica 1s² 2s² 2p⁶. Por outro lado, o átomo de cloro (Cℓ), com número atômico 17 e configuração eletrônica 1s² 2s² 2p⁶ 3s² 3p⁵, tende a ganhar um elétron para completar sua camada de valência e se tornar um íon negativo (Cℓ⁻), atingindo a configuração estável do argônio (Ar).
Outro exemplo interessante é o do carbono (C), que possui a configuração eletrônica 1s² 2s² 2p². O carbono tende a compartilhar elétrons para completar sua camada de valência, formando quatro ligações covalentes. Em compostos como o metano (CH₄), o carbono compartilha seus quatro elétrons com quatro átomos de hidrogênio, alcançando a configuração de oito elétrons ao redor de sua camada de valência.
Portanto, a regra do octeto é essencial para entender as ligações químicas. Átomos como o sódio, que perdem elétrons, formam ligações iônicas com átomos que ganham elétrons, como o cloro. Já átomos como o carbono, que compartilham elétrons, formam ligações covalentes. Em ambos os casos, o objetivo é sempre o mesmo: alcançar uma configuração de octeto, garantindo estabilidade.
Leia também: A relação da distribuição eletrônica com a disposição dos elementos na tabela periódica
Exceções à regra do octeto
Embora a regra do octeto seja amplamente aplicável, há várias exceções que envolvem átomos que não seguem essa regra. Esses casos são comuns em compostos que contêm átomos com menos de oito ou mais de oito elétrons na camada de valência.
Um exemplo clássico de exceção é o trifluoreto de boro (BF₃). O boro, com número atômico 5 e configuração eletrônica 1s² 2s² 2p¹, forma três ligações covalentes com átomos de flúor. No entanto, após essas ligações, o boro permanece com apenas seis elétrons ao redor de sua camada de valência, não alcançando o octeto. Essa deficiência de elétrons torna o BF₃ uma molécula "eletrófila", ou seja, capaz de aceitar elétrons de outras moléculas para completar seu octeto em reações químicas.
Outro exemplo importante é o pentafluoreto de fósforo (PF₅). O fósforo (P), com número atômico 15 e configuração eletrônica 1s² 2s² 2p⁶ 3s² 3p³, pode expandir sua camada de valência para acomodar mais de oito elétrons. No caso do PF₅, o fósforo forma cinco ligações covalentes com átomos de flúor, resultando em dez elétrons ao redor do átomo de fósforo. Esse fenômeno é possível porque, a partir do terceiro período da tabela periódica, os elementos possuem orbitais d que podem ser utilizados para acomodar elétrons extra.
Além disso, elementos como o hidrogênio, lítio e berílio também não seguem a regra do octeto. O hidrogênio, por exemplo, é estável com apenas dois elétrons na camada de valência (regra do dueto), enquanto o lítio (Li) e o berílio (Be) formam compostos com menos de oito elétrons, como no caso do hidreto de lítio (LiH) e o difluoreto de berílio (BeF₂), respectivamente. Para conferir mais exceções à regra do octeto, clique aqui.
Regra do octeto e os gases nobres
A regra do octeto está diretamente ligada à estabilidade dos gases nobres. Esses elementos, localizados no grupo 18 da tabela periódica, possuem camadas de valência completas, o que os torna extremamente estáveis e quimicamente inertes. Por exemplo, o gás hélio (He) tem dois elétrons, enquanto o neônio (Ne) e o argônio (Ar) possuem oito elétrons em suas camadas de valência, tornando-os energeticamente estáveis e, portanto, pouco reativos.
Contudo, existem algumas exceções até mesmo para os gases nobres. O xenônio (Xe), um dos gases nobres mais pesados, pode formar compostos com elementos altamente eletronegativos, como o flúor. O pentafluoreto de xenônio (XeF₅) é um exemplo de composto em que o xenônio quebra sua "inércia" química devido à forte atração que o flúor exerce sobre seus elétrons. Isso demonstra que, apesar de serem estáveis, os gases nobres podem participar de reações químicas sob certas condições extremas.
Regra do dueto
Além da regra do octeto, existe a regra do dueto, aplicável a átomos que podem alcançar estabilidade com apenas dois elétrons na camada de valência. O hidrogênio é o exemplo mais claro disso. Com número atômico 1 e a configuração eletrônica 1s¹, o hidrogênio só precisa de mais um elétron para preencher sua primeira e única camada de valência, tornando-se estável como o hélio (He), que possui a configuração 1s².
Outro exemplo de aplicação da regra do dueto é o lítio (Li), que, com número atômico 3 e configuração eletrônica 1s² 2s¹, perde um elétron para alcançar a configuração estável de hélio. O berílio (Be), com número atômico 4 e configuração eletrônica 1s² 2s², também segue uma lógica semelhante, formando compostos em que não atinge o octeto, mas se estabiliza com quatro elétrons ao redor de sua camada de valência.
Leia também: Reações químicas — o que são e quando acontecem
Exercícios sobre regra do octeto
Questão 1
(PUC) Qual das seguintes séries contém todos os compostos covalentes, cuja estabilização ocorre sem que atinjam o octeto?
a) BeCl2, BF3, H3BO3, PCl5.
b) CO, NH3, HClO, H2SO3.
c) CO2, NH4OH, HClO2, H2SO4.
d) HClO3, HNO3, H2CO3, SO3.
e) HCl, HNO3, HCN, SO3.
Resolução:
A alternativa correta é a letra A.
Como vimos anteriormente, alguns elementos podem adquirir estabilidade sem apresentar oito elétrons na camada de valência. Entre eles, estão: o berílio, que é estável com 4 elétrons na camada de valência; boro, que atinge a estabilidade com 6 elétrons na camada de valência; e fósforo, que é estável com 10 elétrons na camada de valência.
Questão 2
A regra do octeto é uma importante diretriz utilizada para explicar a estabilidade das ligações químicas entre átomos. Segundo essa regra, os átomos tendem a se ligar de maneira a completar sua camada de valência com oito elétrons, adquirindo uma configuração eletrônica semelhante à dos gases nobres, que são estáveis.
Considere as seguintes moléculas e íons:
I. CO2 (dióxido de carbono)
II. Cl− (íon cloreto)
III. CH4 (metano)
IV. BF3 (trifluoreto de boro)
Com base na regra do octeto e no comportamento dos átomos para obter estabilidade, assinale a alternativa correta.
a) Todas as espécies químicas mencionadas seguem a regra do octeto.
b) Apenas o dióxido de carbono e o metano seguem a regra do octeto.
c) O trifluoreto de boro e o íon cloreto seguem a regra do octeto.
d) Apenas o íon cloreto segue a regra do octeto.
e) Nenhuma das espécies químicas segue a regra do octeto.
Resolução:
A alternativa correta é a letra B.
Apenas o dióxido de carbono e o metano seguem a regra do octeto.
Para resolver essa questão, é necessário avaliar cada espécie química em relação à regra do octeto:
O carbono (C) possui 4 elétrons na camada de valência e precisa de mais 4 elétrons para completar o octeto. O oxigênio (O), por sua vez, possui 6 elétrons na camada de valência e necessita de mais 2 para completar o octeto. No dióxido de carbono, cada átomo de oxigênio forma uma ligação dupla com o carbono, o que permite que ambos os elementos completem seus octetos. Logo, CO2 segue a regra do octeto.
O átomo de cloro (Cl) possui 7 elétrons na camada de valência. Quando ele ganha um elétron, forma o íon cloreto (Cl−), completando sua camada de valência com 8 elétrons. Portanto, Cl− segue a regra do octeto.
O carbono, com 4 elétrons na camada de valência, forma quatro ligações simples com os átomos de hidrogênio (H), que têm apenas 1 elétron. Cada hidrogênio atinge a configuração de dueto (2 elétrons), e o carbono completa seu octeto ao compartilhar os 4 elétrons necessários. Logo, CH4 segue a regra do octeto.
O boro (B) tem apenas 3 elétrons na camada de valência e forma três ligações covalentes com os átomos de flúor (F), resultando em apenas 6 elétrons ao redor do boro. Nesse caso, o boro não completa um octeto e constitui uma exceção à regra do octeto. Portanto, BF3 não segue a regra do octeto.
Fontes
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed. Porto Alegre, Bookman, 2006.
CHANG, Raymond. Química Geral: Conceitos Essenciais. 4ªed. São Paulo, McGraw-Hill, 2007.


