Molécula
A molécula é uma entidade química eletricamente neutra que pode ser formada por dois ou mais átomos. Quando várias moléculas do mesmo tipo estão juntas, tem-se uma substância química pura, configurando a matéria.
As moléculas podem ser classificadas, quanto à sua composição, em homonuclear ou heteronuclear; quanto ao número de átomos, em biatômica, diatômica ou poliatômica; e quanto à polaridade, em polar e apolar.
Em geral, as características estruturais da molécula definem propriedades importantes, como solubilidade, ponto de fusão (PF) e ponto de ebulição (PE).
Leia também: O que é o átomo?
Resumo sobre molécula
- Moléculas são entidades eletricamente neutras que consistem em aglomerados de dois ou mais átomos interligados covalentemente.
- São exemplos de moléculas: água (H2O), álcool etílico (CH3CH2OH), gás oxigênio (O2), gás propano (CH3CH2CH3), ácido clorídrico (HCl), ácido sulfúrico (H2SO4), monóxido de carbono (CO), gás carbônico (CO2), entre outras.
- Existem diferentes tipos de moléculas, que podem ser classificadas em:
- Biatômicas: quando formadas por dois átomos. Ex.: O2.
- Triatômicas: quando formadas por três átomos. Ex.: CO2.
- Poliatômicas: quando formadas por quatro ou mais átomos. Ex.: CH4.
- Macromoléculas: quando formadas por centenas ou milhares de átomos. Ex.: proteínas e polímeros.
- Homonucleares: quando formadas por átomos do mesmo elemento químico. Ex.: H2.
- Heteronucleares: quando formadas por átomos de diferentes elementos químicos. Ex.: HCl.
- A geometria molecular é o arranjo espacial que uma molécula adota na tentativa de amenizar a repulsão dos seus pares eletrônicos ligantes e não ligantes.
- A polaridade das moléculas ocorre em decorrência da diferença de eletronegatividade entre os átomos, gerando um polo positivo e um polo negativo na molécula.
- Molécula polar: apresenta momento de dipolo resultante. Ex.: água (H2O).
- Molécula apolar: não apresenta momento de dipolo resultante. Ex.: CO2.
- O átomo é uma das partículas que compõem a matéria, que apresenta um núcleo positivo, formado por prótons e nêutrons, e eletrosfera, formada por elétrons.
- Substância é um conjunto de moléculas do mesmo tipo e um dos níveis de representação da matéria.
O que são moléculas?
Moléculas são aglomerados de átomos que estão interligados por uma ligação covalente. Em geral, uma molécula é uma entidade eletricamente neutra que pode ser formada por dois ou mais átomos.
A molécula também é comumente chamada de composto químico, e o conjunto de moléculas do mesmo tipo representa um dos níveis de organização da matéria, conhecido como substância pura.
Exemplos de moléculas
Várias moléculas estão no nosso cotidiano na forma de substância. A tabela abaixo lista algumas moléculas importantes.
|
Molécula |
Fórmula molecular |
Fórmula estrutural |
Aplicação |
|
Gás oxigênio |
O2 |
|
Um dos gases presentes na atmosfera, representando 21% da sua composição. É fundamental no processo de respiração da maioria dos seres vivos. |
|
CO2 |
|
Um dos principais gases poluentes e principal produto no processo de combustão. Também é produto da respiração da maioria dos seres vivos. |
|
|
Formol |
CH2O |
|
É amplamente utilizado na produção de resinas, cosméticos e como embalsamante de cadáveres e peças anatômicas. |
|
Metano |
CH4 |
|
É o principal componente do gás natural, utilizado como fonte de energia. Também é conhecido como biogás e pode ser formado em pântanos e aterros sanitários, devido à decomposição de matéria orgânica. |
|
H2O |
|
É um dos principais solventes da terra, sendo fundamental para a manutenção da vida no planeta. |
|
|
Amônia |
NH3 |
|
É bastante utilizada na produção de fertilizantes, além de ser aplicada como gás refrigerante e na produção de produtos de limpeza. |
|
C2H6O |
|
É utilizado como combustível e como aditivo na gasolina, para aumentar a sua octanagem. Também é amplamente empregado na produção de bebidas alcóolicas, além de ser utilizado em procedimentos de assepsia. |
|
|
Ácido acético |
C2H4O2 |
|
É utilizado na produção do vinagre, sendo um importante conservante de alimentos. Além disso, é muito utilizado na produção de produtos de limpeza e na obtenção de medicamentos. |
|
H2SO4
|
|
É um dos componentes da chuva ácida e é muito utilizado na produção de fertilizantes. Também é empregado na produção de baterias, além de ser utilizado no tratamento de água para ajustar o pH. |
Quais são os tipos de moléculas?
Existem diferentes tipos de moléculas, que podem ser classificadas de acordo com sua composição e características.
→ Tipos de moléculas quanto à quantidade de átomos
- Biatômica: é formada por dois átomos. Ex.: O2 e CO.
- Triatômica: é formada por três átomos. Ex.: O3 e CO2.
- Poliatômica: é formada por quatro ou mais átomos. Ex.: NH3 e CH4.
- Macromoléculas: são formadas por centenas ou milhares de átomos. Ex.: proteínas, polímeros e o DNA.
→ Tipos de moléculas quanto ao tipo de átomos
- Homonuclear: é formada por átomos do mesmo elemento químico. Ex.: H2.
- Heteronuclear: é formada por átomos de diferentes elementos químicos. Ex.: HCl.
→ Tipos de moléculas quanto à polaridade
- Molécula polar: apresenta momento de dipolo resultante. Ex.: água (H2O), álcool etílico (CH3CH2OH).
- Molécula apolar: não apresenta momento de dipolo resultante. Ex.: H2, O2, CO2.
Geometria molecular
A geometria molecular é o arranjo tridimensional dos átomos no espaço e se origina da repulsão dos pares eletrônicos, ligantes e não ligantes, dos átomos que compõem a molécula. O arranjo é justificado pela teoria de repulsão dos pares eletrônicos da camada de valência (TRPECV). A TRPECV propõe que, na tentativa de amenizar a repulsão entre os pares eletrônicos, os elétrons ligantes e não ligantes se afastem uns dos outros, gerando ângulos entre os átomos da molécula.
Em geral, moléculas formadas por apenas dois átomos, sejam do mesmo tipo, sejam de tipos diferentes, terão sempre geometria molecular linear. Alguns exemplos são o hidrogênio molecular (H2), oxigênio molecular (O2), nitrogênio molecular (N2), ácido clorídrico (HCl), entre outros.
Moléculas que apresentam três, ou mais, tipos de átomos diferentes em sua composição podem apresentar diferentes geometrias moleculares. A imagem abaixo mostra os principais casos de geometria molecular em algumas moléculas com três ou mais átomos.

Polaridade das moléculas
A polaridade de uma molécula é definida por sua geometria e pela eletronegatividade dos átomos na extremidade de uma ligação.
Na molécula, átomos mais eletronegativos atraem a densidade eletrônica para si, deixando o átomo menos eletronegativo deficiente de elétrons. Isso faz com que se formem polos positivos e negativos na molécula. Essa separação de cargas na molécula é medida pelo momento de dipolo (\(\vec{\mu}\)), representado por um vetor que aponta na direção do átomo mais eletronegativo, como mostra a figura abaixo, no caso do ácido clorídrico (HCl) e da água (H2O).
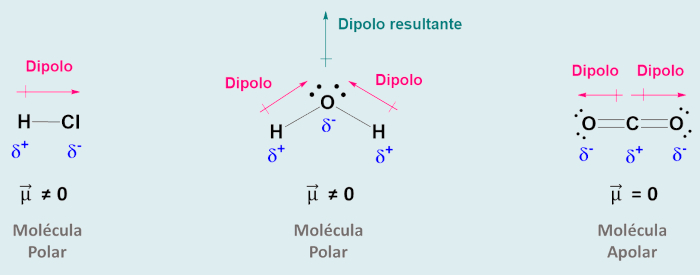
Quando a molécula apresenta átomos eletronegativos em direções opostas, os vetores se anulam e a molécula passa a ter um momento de dipolo nulo, como no caso da molécula do CO2, que apresenta uma geometria linear.
Porém, quando a molécula apresenta um ângulo, os momentos de dipolo se somam e geram um momento de dipolo resultante, como pode ser visto na molécula da água, que apresenta uma geometria angular.
Em geral, quando o momento de dipolo resultante é diferente de zero, a molécula é classificada como polar. Por outro lado, quando o momento de dipolo resultante é igual a zero, a molécula é classificada como apolar (sem polo).
Confira também: Polaridade das moléculas — mais detalhes sobre essa propriedade
Diferenças entre molécula, átomo e substância
Apesar de existir uma relação de proximidade entre os termos “molécula”, “átomo” e “substância”, pois todos representam níveis de organização da matéria, existe uma diferença significativa entre eles.
- Molécula: é um conjunto de átomos que estão unidos entre si por meio de ligações do tipo covalente. A molécula pode apresentar dois ou mais átomos, podendo ser do mesmo elemento ou de elementos diferentes. Um exemplo é a molécula do etanol, CH3CH2OH, formada por átomos de carbono (C), hidrogênio (H) e oxigênio (O).
- Átomo: é a menor partícula que caracteriza um elemento químico e é formado por um núcleo positivo e denso, representando 99,9% da sua massa, e uma eletrosfera que determina o seu tamanho. O núcleo é composto por prótons (carga positiva) e nêutrons (sem carga), enquanto a eletrosfera é composta exclusivamente por elétrons (carga negativa). É o balanço entre essas cargas, positivas e negativas, que determina a neutralidade da matéria.
- Substância: é a matéria de composição constante, podendo ser formada por moléculas ou por átomos. Ela apresenta propriedades físicas específicas, como densidade, condutividade elétrica, ponto de fusão e ebulição, utilizados na caracterização do tipo de matéria. A substância pode ser classificada como simples ou composta:
- Substância simples: é formada por um único tipo de elemento químico, independentemente da sua atomicidade. Ex.: H2, O2, O3, S8, Fe, Al.
- Substância composta: é formada por dois, ou mais, tipos diferentes de elementos químicos. Ex.: H2O, CH4, NaHCO3, H2SO4, HCl.
Vale destacar aqui o termo “elemento químico”, que representa o conjunto de átomos do mesmo tipo e que também pode ser entendido como uma substância simples pura. É o caso do ferro (Fe) e alumínio (Al), citados no exemplo de substância simples.
Exercícios resolvidos sobre moléculas
Questão 1
(UFTM) Os gases amônia, dióxido de carbono e trióxido de enxofre são insumos importantes na indústria química. Em relação à polaridade de suas moléculas, é correto afirmar que NH3, CO2 e SO3 são, respectivamente,
A) polar, polar e apolar.
B) polar, apolar e polar.
C) polar, apolar e apolar.
D) apolar, polar e apolar.
E) apolar, apolar e polar.
Resolução:
Alternativa C.
O NH3 apresenta três dipolos na direção do nitrogênio, átomo mais eletronegativo, gerando um momento de dipolo resultante, tornando a molécula polar, como mostra a imagem abaixo.
Já o CO2 apresenta momentos de dipolo em direções opostas, fazendo com que eles se anulem e gere-se um momento de dipolo igual a zero, tornando a molécula apolar.
Por outro lado, o SO3 apresenta três momentos de dipolo resultante em direções opostas aos dipolos de cada ligação, fazendo com que os momentos de dipolo e os dipolos se anulem, gerando uma molécula apolar.
Dessa forma, temos NH3 (polar), CO2 (apolar) e SO3 (apolar), respectivamente, como mostra a alternativa C.
Questão 2
(UPE) Uma pesquisa publicada na Nature, em 2020, identificou indícios de vida no planeta Vênus. Os pesquisadores encontraram gás fosfina (formado por fósforo e hidrogênio), que, mesmo não garantindo a existência de vida, permite a hipótese de produção por microorganismos, pois o hidrogênio não é um gás comum na atmosfera do planeta. “A molécula de fosfina é muito difícil de ser produzida. Na Terra, sua produção só é possível em indústrias, laboratórios ou por bactérias anaeróbicas.”
Números Atômicos – H = 1; P = 15
Sobre a fosfina, é CORRETO afirmar que Dados:
A) pode ser representada pela fórmula estrutural PH4.
B) se trata de um composto iônico, pois é grande a diferença de eletronegatividade entre o hidrogênio e o fósforo.
C) se trata de um composto covalente, em que a ligação entre hidrogênio e fósforo é do tipo pi.
D) apresenta geometria molecular piramidal.
E) se trata de um composto orgânico, uma vez que é produzido por microorganismos anaeróbicos no nosso planeta.
Resolução:
Alternativa D.
O fósforo (P) apresenta 5 elétrons na camada de valência, enquanto o hidrogênio (H) apresenta 1 elétron na camada de valência, como mostra as distribuições eletrônicas abaixo:
- Distribuição do fósforo (Z =15): 1s2 2s2 2p6 3s2 3p3
- Distribuição do hidrogênio (Z =1): 1s1
O fósforo seguirá a regra do octeto e, por isso, faz três ligações, ou seja, liga-se a três hidrogênios, que se estabilizam com 2 elétrons, formando uma única ligação. Dessa forma, o composto formado é a fosfina (PH3), como mostra a imagem abaixo.

Sabendo disso, podemos interpretar as alternativas da questão:
A) está errada porque o composto formado é o PH3.
B) está errada porque o composto é formado por ligações covalentes, pois o hidrogênio e o fósforo são ametais. Ligações iônicas são formadas apenas entre metais e ametais.
C) está errada porque a ligação entre o fósforo e o hidrogênio é simples, do tipo sigma.
D) está correta. Devido ao par de elétrons livres no fósforo, há uma repulsão entre os pares de elétrons, forçando as ligações para baixo, gerando ângulos que caracterizam uma geometria piramidal trigonal.
E) está errada, pois o que caracteriza um composto orgânico é a presença de carbonos e hidrogênios interligados, que podem se apresentar em diferentes cadeias carbônicas.
Fontes
BROWN, Theodore L. et al. Química: a ciência central. 9.ed. São Paulo: Prentice Hall, 2005.
CHANG, Raymond; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo: McGraw-Hill;2007.
IUPAC. Molecule. Gold Book. Disponível em: https://goldbook.iupac.org/terms/view/M04002.
IUPAC. Atom. Gold Book. Disponível em: https://goldbook.iupac.org/terms/view/A00493.
IUPAC. Chemical substance. Gold Book. Disponível em: https://goldbook.iupac.org/terms/view/C01039.
IUPAC, Chemical element. Gold Book. Disponível em: https://goldbook.iupac.org/terms/view/C01022.