Ordem de uma Reação
No texto “Lei da Velocidade para uma Reação” determinou-se que a lei da velocidade de uma reação é dada pela expressão matemática a seguir, que relaciona as concentrações dos reagentes com a velocidade da reação: v = k [A]α. [B]β
Os expoentes nessa equação nem sempre são iguais aos coeficientes da equação química balanceada. A única maneira de se determinar com certeza o expoente na equação da velocidade é fazendo vários experimentos.
É importante determinar os coeficientes corretamente, pois eles indicarão a ordem da reação, que é definida da seguinte maneira:

A ordem de uma reação também pode ser interpretada em relação a cada reagente:

Vejamos um exemplo:
2 NO(g) + 1 Br2(g) → 2 NOBr(g)
A reação acima, entre o óxido nítrico e o bromo, ocorre à temperatura de 273ºC. Ao realizar uma série de experimentos, nos quais se alterou a concentração dos reagentes, obtiveram-se os seguintes dados da tabela abaixo:
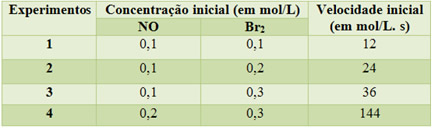
Observe que do experimento 1 para o 2 dobrou-se a concentração do bromo, e o resultado foi que a velocidade da reação também dobrou. Assim, o expoente dessa substância será igual a 1.
Já no caso do óxido nítrico, do experimento 3 para o 4, sua concentração também foi dobrada, porém, a velocidade quadruplicou, pois foi de 36 mol. L-1. s-1 para 144 mol. L-1. s-1. Portanto, o seu expoente será 2. Desse modo, temos que a lei da velocidade para essa reação será dada pela seguinte equação:
v = k [NO]2. [Br2]1
Assim, essa reação é de:
- 2ª ordem em relação a NO;
- 1ª ordem em relação a Br2;
- 3ª ordem em relação à reação global (soma dos expoentes: 2+1 = 3).
Observe que os valores dos expoentes são iguais aos valores dos respectivos coeficientes dessas substâncias na equação química balanceada. Isso se dá porque essa reação é elementar, isto é, ocorre em uma única etapa. Por isso, temos que:

No caso de reações não elementares, a etapa lenta será a etapa determinante da ordem da reação. Um exemplo de reação não elementar, que se desenvolve em mais de uma etapa distinta, é a que ocorre entre o gás hidrogênio e o monóxido de nitrogênio para a formação do gás nitrogênio e da água.
Essa reação se processa segundo as seguintes etapas:
Etapa 1 (lenta): 1 H2(g) + 2 NO(g) → 1 N2Og) + 2 H2O(l)
Etapa 2 (rápida): 1 N2Og) + 2 H2O(l) → 1 N2(g) + 2 H2O(l)
Equação global: 2 H2(g) + 2 NO(g) → 1 N2(g) + 2 H2O(l)
A lei da velocidade e os expoentes dessa reação serão dados pelos coeficientes dos reagentes na etapa lenta. Portanto, temos:
v = k [H2]1 . [NO]2
Essa reação é de:
- 1ª ordem em relação a H2;
- 2ª ordem em relação a NO;
- 3ª ordem em relação à reação global (soma dos expoentes: 1+2 = 3).
Nesse caso, podemos ver que os coeficientes da equação global não são iguais aos expoentes na expressão da lei da velocidade.
Observação: Se acontecer de mudarmos a concentração de uma substância reagente e a velocidade da reação não se alterar, a ordem de reação dessa substância será igual a zero, pois ela não participa da equação da velocidade.

