Teoria das Colisões
A Teoria das Colisões diz que, para que uma reação ocorra, a colisão entre as partículas das substâncias reagentes deve acontecer por meio de uma orientação adequada e com uma energia maior que a energia mínima necessária para a ocorrência da reação.
Essa energia mínima que deve ser fornecida aos reagentes é denominada Energia de Ativação (Ea). Sem atingi-la, a reação não ocorre.
Quando colocamos duas substâncias em contato, suas partículas começam a colidir umas com as outras. Nem todas as colisões são eficazes, isto é, nem todas dão origem a novos produtos. No entanto, as colisões que rompem as ligações formadas e formam novas ligações, são denominadas colisões eficazes ou efetivas.
Essas colisões ocorrem de forma adequada: seu choque é frontal geometricamente e bem orientado. Observe abaixo como isso ocorre:
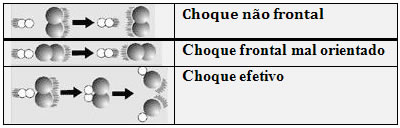
No choque efetivo as moléculas absorvem a quantidade de energia mínima necessária (energia de ativação) para a formação do complexo ativado, ou seja, um estado intermediário (estado de transição) entre os reagentes e os produtos. Nessa estrutura, as ligações dos reagentes estão enfraquecidas e as dos produtos estão sendo formadas.
Observe uma reação genérica que mostra essa formação do complexo ativado abaixo:
AB + XY → AX + YB
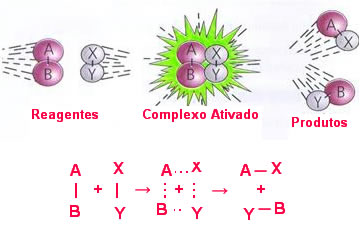
Note que quando ocorre o choque efetivo, forma-se momentaneamente o complexo ativado, no qual as ligações entre os átomos AB e XY estão se rompendo e as ligações que unirão os átomos nas moléculas AX e YB estão se formando.
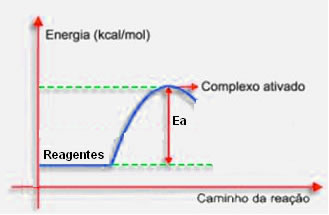
Observe no diagrama que se não for atingida a energia de ativação, não é possível formar o complexo ativado, pois ela serve como uma barreira energética a ser ultrapassada para que a reação química ocorra.
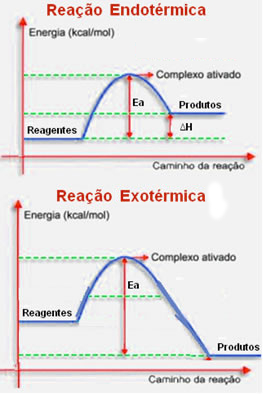
Para reações exotérmicas (reações que liberam energia - ?H < 0) e endotérmicas (reações que absorvem energia - ?H > 0), temos os diagramas:
Assim, a teoria das colisões explica satisfatoriamente a rapidez com que ocorrem as reações, pois:
![]()

