Lei da Velocidade para uma Reação
Um dos fatores que interferem na velocidade, rapidez ou taxa de desenvolvimento de uma reação química é a concentração dos reagentes. Conforme dito no texto “Influência da Concentração na Velocidade das Reações”, geralmente, um aumento na concentração dos reagentes aumenta a rapidez de uma reação.
Isso pode ser visto na reação de decomposição da água oxigenada (solução aquosa de peróxido de hidrogênio):
H2O2(l) → H2O(l) + ½ O2(g)
A seguir temos uma tabela com dados obtidos experimentalmente e que relaciona a concentração do reagente, em temperatura constante (25ºC) com a velocidade da reação:
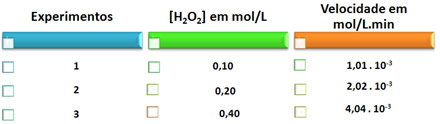
Observe que do experimento 1 para o 2 dobrou-se a concentração da água oxigenada e o resultado foi que a velocidade da reação de decomposição também dobrou. Já do experimento 1 para o 3, tanto a concentração do reagente como a velocidade da reação quadruplicaram.
Isso nos leva a concluir corretamente que a concentração em mol/L é diretamente proporcional à velocidade da reação. Essa relação entre a rapidez de uma reação e as concentrações dos reagentes é dada por uma expressão matemática que é denominada lei da velocidade da reação. Assim, para a reação descrita essa lei é representada da seguinte forma:
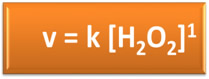
Nessa equação, k é uma constante característica de cada reação que varia exclusivamente com a temperatura. Veja também que a concentração do reagente é representada por colchetes [ ].
A lei da velocidade de uma reação também é denominada como Lei da Ação das Massas, Equação de Rapidez ou ainda Lei Cinética da Reação.
Assim, para uma reação genérica balanceada, temos:
aA + bB → cC + dD

Os símbolos α e β são expoentes que são determinados experimentalmente. Na reação da água oxigenada mencionada acima o expoente foi igual a 1, que é o mesmo valor do coeficiente dessa substância na reação. Porém, isso não ocorre sempre. Somente em reações elementares, isto é, que se desenvolvem em uma única etapa, é que ocorrerá dos expoentes na expressão da lei da velocidade serem iguais aos respectivos coeficientes..
Entretanto, é importante lembrar que, na prática, isso nem sempre acontece. Quando a reação não é elementar, ocorrendo em mais de uma etapa, é necessário determinar experimentalmente os valores dos expoentes. Isso será determinado pela primeira etapa da reação, que é a fase lenta.
Veja também o texto “Ordem de uma reação” para você entender melhor como isso é feito.

