Oxidação e Redução
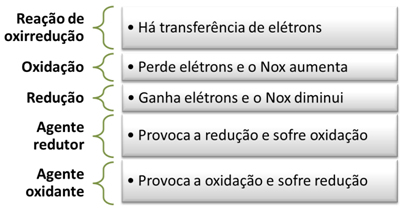
A oxidação e a redução são fenômenos que ocorrem simultaneamente em reações em que há transferência de elétrons entre os átomos. Esses fenômenos também são chamados de oxirredução, oxidorredução ou redox.
A oxidação ocorre quando o elemento perde elétrons e o seu número de oxidação (Nox) aumenta.
O Nox, como poderá ser visto no texto Número de Oxidação (Nox), é a carga elétrica que o elemento adquire quando faz uma ligação iônica ou o caráter parcial que ele adquire quando faz uma ligação predominantemente covalente.
Já a redução ocorre quando o elemento ganha elétrons e o seu número de oxidação diminui.
Veja um exemplo: na formação do sal de cozinha (cloreto de sódio – NaCl), o sódio cede definitivamente um elétron para o cloro, formando o cátion Na+, ou seja, ele sofre oxidação, pois perdeu um elétron e seu Nox aumentou de zero para +1. Simultaneamente, o cloro recebe um elétron, formando o ânion cloreto (Cl-), ou seja, sofre redução, pois seu Nox passou de zero para -1.
0 0 +1 -1
2 Na(s) + 1 Cl2(g) → 2 NaCl(s)
Nesse exemplo, o sódio é chamado de agente redutor, pois foi ele quem forneceu o elétron para o cloro, provocando a sua redução. Já o cloro é o agente oxidante, pois ele provocou a oxidação do sódio, recebendo o elétron dele.
Resumidamente, temos:
As reações de oxirredução são bastante comuns em nosso cotidiano, como quando um prego enferruja. O prego é feito de ferro, que com o tempo se oxida em contato com o oxigênio e com a água, formando o Fe2O3 . 3H2O, que é a ferrugem:
Fe(s) → Fe2+ + 2e- (oxidação do ferro)
O2 + 2H2O + 4e- → 4OH- (redução do oxigênio)
2Fe + O2 + 2H2O → 2Fe(OH)2 ou Fe2O3 . 3H2O (equação geral da formação da ferrugem)
Portanto, nessa reação, o ferro sofre oxidação, sendo o agente redutor; e o oxigênio sofre redução, sendo o agente oxidante.

