Óxidos Básicos
Os óxidos, compostos formados por dois elementos (binários), em que o oxigênio é o mais eletronegativo, podem ser classificados em óxidos básicos.
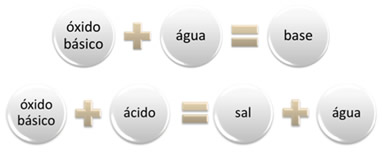
Um óxido básico é aquele que ao reagir com água gera uma base, ou, ao reagir com um ácido, produz sal e água.
Exemplos: Na2O, K2O, CaO, MgO.
ÓXIDO ÁGUA BASE
1 Na2O(g) + 1 H2O(l) → 2 NaOH(aq)
óxido de água hidróxido de
sódio sódio
1 CaO(g) + 1 H2O(l) → 1 Ca(OH)2(aq)
óxido de cálcio água hidróxido de cálcio
ÓXIDO ÁCIDO SAL ÁGUA
1 Na2O(g) + 1 H2SO4 (aq) → 1 Na2SO4 (aq) + 1 H2O
óxido de ácido sulfato de água
sódio sulfúrico sódio
1 CaO(g) + 2 HCl(aq) → 1 CaCl2(aq) + 1 H2O
óxido de ácido cloreto de água
cálcio clorídrico cálcio
Os óxidos básicos são formados por metais com números de oxidação baixos (+1, +2 ou +3), elementos com alta eletropositividade, e são sólidos iônicos com pontos de fusão e ebulição elevados.
Além disso, os óxidos básicos também podem reagir om óxidos ácidos, produzindo um sal, como no exemplo a seguir:
1 CO2(g) + 1 CaO(aq) → 1 CaCO3(ppt)
dióxido de carbono óxido de cálcio carbonato de cálcio
Um exemplo importante de óxido básico que pode ser citado é o óxido de potássio (K2O), encontrado na cinza da madeira e do cigarro. Quando esse composto entra em contato com a água, ele produz o KOH. É por isso que antigamente, em locais onde não havia hidróxido de sódio (NaOH) para produzir sabão, utilizavam-se cinzas de madeira para reagir com a gordura, pois o KOH o substituía. Esse sabão era conhecido como “sabão de cinza”.

