Eletrólise
A eletrólise é um processo que converte energia elétrica em energia química, promovendo reações que não aconteceriam espontaneamente. Em vista disso, ela é amplamente utilizada para a produção de metais, como o alumínio, e para processos de purificação ou deposição de substâncias, como na galvanoplastia. Em outras palavras, é esse processo que torna possível a produção de alumínio para utensílios de cozinha e até o revestimento de joias e peças automotivas com metais resistentes à corrosão. Além disso, ela desempenha um importante papel na purificação da água, na produção de baterias recarregáveis e até na fabricação de medicamentos. Ou seja, é uma tecnologia indispensável em nossa vida moderna.
Leia também: Pilha de Daniell — dispositivo que converte energia química em energia elétrica
Resumo sobre eletrólise
-
Eletrólise é o processo de decomposição de substâncias através da passagem de corrente elétrica.
-
Ocorre em células eletrolíticas com dois eletrodos, o ânodo e o cátodo, imersos em um eletrólito.
-
Há dois tipos principais de eletrólise: ígnea (em substâncias fundidas) e aquosa (em soluções aquosas).
-
O processo envolve reações de oxidação no ânodo e de redução no cátodo.
-
Michael Faraday formulou as leis da eletrólise, que quantificam a relação entre corrente elétrica e substâncias depositadas.
-
Tem aplicação na produção de metais, purificação de substâncias, produção de gases e galvanoplastia.
-
É importante por permitir reações não espontâneas, transformando energia elétrica em energia química.
Videoaula sobre eletrólise
O que é eletrólise?
Eletrólise é um processo químico no qual ocorre a decomposição de uma substância por meio da passagem de uma corrente elétrica, isto é, trata-se de uma reação não espontânea, cujo processo forçado envolve a transferência de elétrons em reações de oxirredução, que acontecem nos eletrodos (ânodo e cátodo) mergulhados em uma solução eletrolítica ou em um material fundido.
Quais são as leis da eletrólise?
As leis da eletrólise, formuladas por Michael Faraday em 1833, descrevem quantitativamente as relações entre a corrente elétrica e a quantidade de substâncias envolvidas nas reações eletrolíticas. Elas são duas:
-
Primeira lei de Faraday: estabelece que a massa de uma substância depositada ou liberada em um eletrodo é diretamente proporcional à quantidade de carga elétrica que atravessa o circuito. Ela é expressa da seguinte forma:
\(m = k \cdot Q \)
Onde:
m é a massa da substância liberada ou depositada.
k é a constante de proporcionalidade (eletroquímico equivalente).
Q é a carga elétrica total, que é dada por \(Q = I \cdot t \)
onde I é a corrente e t o tempo.
-
Segunda lei de Faraday: afirma que a massa de diferentes substâncias depositadas ou liberadas pela mesma quantidade de carga elétrica é proporcional aos seus equivalentes químicos, ou seja, ao quociente entre a massa molar e a valência (número de elétrons envolvidos). Assim, substâncias com diferentes equivalentes químicos produzirão massas proporcionais durante a eletrólise.
Matematicamente, ela pode ser expressa como:
\(m = \frac{M \cdot I \cdot t}{n \cdot F} \ \ ou \ m = \frac{M \cdot Q}{n \cdot F} \)
Onde:
m é a massa da substância depositada ou liberada (em gramas).
M é a massa molar da substância (g/mol).
Q é a carga elétrica total passada pelo sistema (em coulombs): Q = I.t (I é a corrente e t o tempo).
n é o número de elétrons envolvidos na reação (valência).
F é a constante de Faraday, aproximadamente 96.485 C/mol (costuma ser arredondada para 96.500), que representa a carga de um mol de elétrons.
Exemplo:
Vamos calcular a massa de cobre depositada pela passagem de uma corrente de 2 A durante 30 minutos (1.800 segundos) em uma solução de sulfato de cobre (CuSO4).
Dados:
M = 63,5 g/mol
Valência é n = 2, pois o Cu2+ precisa de dois elétrons para se reduzir a cobre metálico.
Aplicando a fórmula:
\(m = \frac{63,5 \times 2 \times 1.800}{2 \times 96.485} \approx 1.185 \text{ g} \)
Posto isso, vale ressaltar que essas leis fundamentam a base quantitativa dos processos eletroquímicos e são amplamente aplicadas na indústria e em experimentos laboratoriais.
Veja também: Afinal, o que é a ferrugem?
Qual a função da eletrólise?
A função da eletrólise é, portanto, promover reações químicas não espontâneas por meio da aplicação de uma corrente elétrica. Em vista disso, esse processo é utilizado principalmente para separar substâncias, produzir elementos químicos (como hidrogênio, oxigênio e metais), realizar a purificação de metais e para revestimentos metálicos, como na galvanoplastia. Em outras palavras, a eletrólise é usada para transformar energia elétrica em energia química.
Processo de eletrólise
O processo de eletrólise consiste na aplicação de uma corrente elétrica contínua a uma célula eletrolítica, composta por dois eletrodos (ânodo e cátodo) imersos em um eletrólito que pode ser uma substância iônica dissolvida ou fundida. Isso acontece em duas fases principais:
-
Passagem da corrente elétrica: a fonte de energia elétrica faz com que os íons no eletrólito se movam. Com isso, os cátions (íons positivos) migram para o cátodo (eletrodo negativo), e os ânions (íons negativos) para o ânodo (eletrodo positivo).
-
Reações nos eletrodos: ao alcançarem os eletrodos, os íons sofrem as seguintes reações:
- No cátodo, ocorre uma reação de redução (ganho de elétrons) nos cátions.
- No ânodo, ocorre uma reação de oxidação (perda de elétrons) nos ânions.
Diante disso, os íons são transformados em substâncias elementares (como metais, gases ou compostos), que podem se depositar nos eletrodos ou se liberar como gases.
Esquema de uma eletrólise
Para uma melhor compreensão da eletrólise, segue abaixo um esquema desse processo:
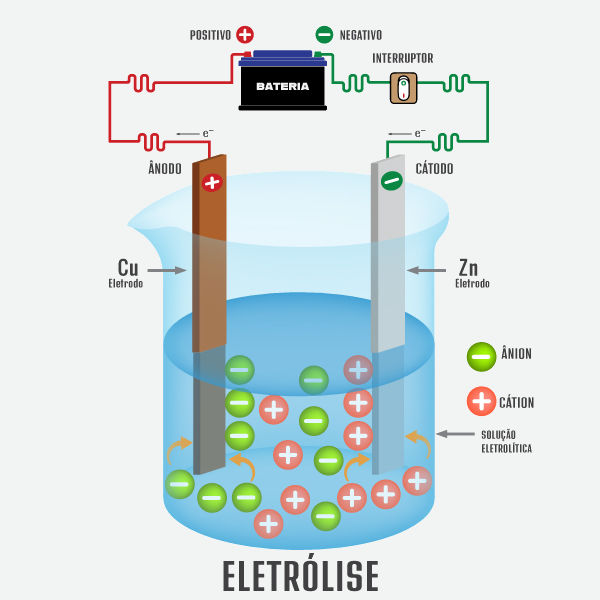
Tipos de eletrólise
Basicamente existem dois tipos principais de eletrólise: eletrólise ígnea e eletrólise aquosa, as quais diferem pelo meio em que ocorrem e pelos íons envolvidos no processo. A seguir, falaremos um pouco sobre como funciona cada uma delas.
-
Eletrólise ígnea: ocorre em substâncias iônicas fundidas (no estado líquido, após aquecimento). Nesse processo, não há água envolvida, e a eletrólise acontece diretamente nos íons da substância fundida. Um exemplo é a obtenção de metais como alumínio por meio da eletrólise da bauxita fundida. Saiba mais sobre esse tipo de eletrólise clicando aqui.
-
Eletrólise aquosa: ocorre em soluções aquosas, onde a água também pode participar do processo. Além dos íons da substância dissolvida, os íons da água (H⁺ e OH⁻) podem sofrer oxirredução. Por exemplo, a eletrólise da água resulta na formação de hidrogênio e oxigênio gasosos, conforme o esquema abaixo:
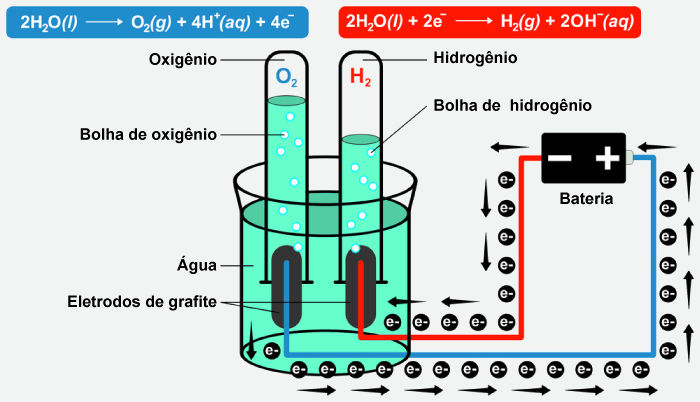
Aplicações da eletrólise
As aplicações da eletrólise são amplas, visto que ela integra diversos processos industriais que vão desde a extração de metais à produção de compostos, além de ser útil em estudos científicos. Sendo assim, destacamos a seguir os seus principais usos:
-
Produção de metais: é utilizada na extração de metais por meio de seus minérios, como a produção de alumínio através da bauxita e a obtenção de cobre puro em larga escala.
-
Galvanoplastia: consiste no processo de revestimento de objetos metálicos com camadas de outros metais, como o cromo ou níquel, para proteção contra corrosão ou melhoria estética. Saiba mais sobre esse processo clicando aqui.
-
Produção de gases: a eletrólise da água permite a obtenção de hidrogênio e oxigênio gasosos, usados em processos industriais, na produção de combustíveis e em reações químicas.
-
Purificação de metais: alguns metais, como o cobre e o zinco, são purificados por eletrólise para remover impurezas e obter versões mais puras do material.
-
Indústria química: é utilizada na produção de compostos químicos, como o cloro e o hidróxido de sódio (soda cáustica), por eletrólise de soluções salinas.
Pilhas e eletrólise
Tanto nas pilhas quanto na eletrólise ocorrem reações de oxirredução, ou seja, há transferência de elétrons entre substâncias, envolvendo processos de oxidação e redução, caracterizando, portanto, processos eletroquímicos. Ademais, ambos utilizam dois eletrodos, o cátodo e o ânodo, para conduzir a corrente elétrica, e nos dois sistemas os elétrons fluem do ânodo para o cátodo por meio de um circuito externo. Contudo, há algumas diferenças que as tornam sistemas distintos, as quais podem ser analisadas no quadro abaixo:
|
Características |
Pilhas |
Eletrólise |
|
Espontaneidade da reação |
A reação química é espontânea e gera energia elétrica a partir da energia química. |
A reação é não espontânea, precisando de uma fonte externa de energia elétrica para ocorrer. |
|
Conversão de energia |
Convertem energia química em elétrica. |
Converte energia elétrica em química. |
|
Direção do fluxo de elétrons |
Os elétrons fluem naturalmente do ânodo para o cátodo, produzindo eletricidade. |
Os elétrons são forçados a fluir pelo circuito, impulsionados pela fonte de corrente elétrica. |
|
Função dos eletrodos |
O ânodo é o polo negativo e o cátodo é o polo positivo. |
O ânodo é o polo positivo e o cátodo é o polo negativo, devido à fonte externa de energia. |
Qual é a importância da eletrólise?
Diante de tudo que foi dito até aqui sobre eletrólise, ficou claro o quanto esse processo é importante para o mundo moderno, difundindo-se em diversas indústrias, permitindo a produção, bem como a purificação, de metais essenciais para a tecnologia. Além disso, é usada na obtenção de gases como hidrogênio e oxigênio, vitais para a indústria química e energética. Isso sem falar na sua contribuição na proteção e melhora da durabilidade de materiais pela galvanoplastia. Logo, percebe-se que ela é uma técnica crucial na transformação de energia elétrica em energia química, viabilizando reações que são econômica e tecnologicamente relevantes.
História da eletrólise
A história da eletrólise começa no início do século XIX, quando cientistas começaram a investigar a relação entre eletricidade e reações químicas, sobretudo quando William Nicholson e Anthony Carlisle descobriram a decomposição da água em hidrogênio e oxigênio ao passar uma corrente elétrica por ela, sendo um dos primeiros exemplos de eletrólise. Já em 1833, o físico e químico inglês Michael Faraday realizou experimentos que resultaram nas leis da eletrólise, as quais explicam quantitativamente como a corrente elétrica provoca reações químicas.
A eletrólise ganhou maior relevância industrial no final do século XIX, com o desenvolvimento de processos como a eletrólise do alumínio, utilizando a eletrólise ígnea da bauxita em um procedimento conhecido como processo Hall-Héroult (1886), que revolucionou a produção de alumínio, tornando-o economicamente viável. Outro avanço importante foi a eletrólise de soluções salinas para a produção de produtos químicos, como o cloro e o hidróxido de sódio, essenciais para a indústria química e que ainda é amplamente utilizado.
Saiba mais: Como ocorre a corrosão dos metais
Exercícios resolvidos sobre eletrólise
1ª) (Cederj) Define-se por eletrólise o processo no qual se induz no sistema, artificial e forçadamente, uma corrente – seja ela elétrica ou química – a fim de se obter uma reação química, convertendo energia elétrica em energia química ou vice-versa. Em resumo, quando dois compostos entram em contato químico, seus elementos são separados, de modo forçado, através da corrente elétrica de energia química.
Em relação à eletrólise,
-
o polo positivo é o anodo, em que ocorre a redução.
-
a aquosa é aquela em que não há dissociação de um composto iônico em solução e onde o eletrodo tem que ser inerte.
-
a ígnea é aquela em que não há presença de água e onde metais iônicos são fundidos e se ionizam formando íons.
-
o polo positivo é o catodo, em que ocorre a oxidação.
Gabarito: C
Essa questão aborda os conceitos de eletrólise. Sendo assim, vamos analisar cada item separadamente:
a) Incorreta – O ânodo, de fato, é o polo positivo na eletrólise, mas é onde ocorre a oxidação, não a redução. A redução ocorre no cátodo, que é o polo negativo.
b) Incorreta – Na eletrólise aquosa, ocorre, sim, a dissociação de compostos iônicos em solução. O composto iônico se dissolve na água, e seus íons se dissociam para participar da eletrólise.
c) Correta – A eletrólise ígnea ocorre em substâncias iônicas fundidas, sem a presença de água. Os metais iônicos são aquecidos até se fundirem e formarem íons livres, que sofrem oxidação e redução durante o processo eletrolítico.
d) Incorreta – O cátodo é o polo negativo na eletrólise e é onde ocorre a redução.
2ª)
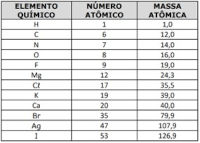
O nitrato de prata tem ampla aplicação em eletrodeposição, na fabricação de vidros e espelhos, podendo ainda ser empregado como germicida e antisséptico. Usando uma solução de nitrato de prata e uma corrente de 2 amperes em uma eletrodeposição, o tempo que um ourives gasta para produzir 48 g de prata é, em horas, aproximadamente
-
4
-
3
-
6
-
5
Gabarito: C
Primeiro, deve-se analisar o contexto da questão, que traz uma reação eletroquímica de eletrólise. Posto isso, é ideal montar a equação química para ter uma ideia de quantos elétrons estão envolvidos nesse processo. Sendo assim, há duas etapas envolvidas, tais quais:
1ª. Ionização do nitrato de prata (AgNO3):
\(\text{AgNO}_3 \rightarrow \text{Ag}^+ + \text{NO}_3^- \)
2ª. Redução dos íons de prata:
\(\text{Ag}^+ + \text{e}^- \rightarrow \text{Ag(s)} \)
Por meio disso, é possível identificar que é necessário apenas 1 elétron para reduzir a prata.
Logo, podemos aplicar a fórmula:
\(m = \frac{M \cdot I \cdot t}{n \cdot F}\)
Mas vale destacar que a questão exige que o aluno conheça o valor da constante de Faraday (~ 96.500), já que não foi fornecido.
Logo, temos os seguintes dados:
m = 48 g
M = 107,9 ou ~108 (massa molar fornecida na tabela)
I = 2 A
F = 96.500 C
n = 1
t = ?
Reorganizando a fórmula para descobrir o tempo (t), teremos:
\(t = \frac{m \cdot n \cdot F}{M \cdot i} \rightarrow t = \frac{48 \times 1 \times 96.500}{108 \times 2}\rightarrow t = \frac{24 \times 96.500}{108} \) = 21.444,4 s (segundos)
Lembre-se de que a questão pede o tempo em horas. Logo, se 1h = 60 min; 1 min = 60 s; 1h = 60 x 60 = 3.600 s.
Sendo assim, temos:
\(t = \frac{21{,}444.4}{3{,}600} = 5,96 \rightarrow t = \sim 6h \)
Fontes
ATKINS, P.; JONES, L. Eletroquímica. In: Princípios de Química: questionando a vida moderna e o meio ambiente. 5. ed. [s.l.] Bookman, 2012. p. 515–550.
L. BROWN, T. et al. Eletrólise. In: Química: a ciência central. 13. ed. São Paulo: Pearson Education do Brasil., 2016. p. 929–931.
REIS, M. Eletrólise com eletrodos ativos. In: Química. 1. ed. São Paulo: Editora Ática, 2013. v. 2p. 306–312.


