Pressão de Vapor
Será que em uma garrafa fechada, como a mostrada acima, há água evaporada?
Se deixarmos essa garrafa por alguns dias em repouso, veremos que o nível da água não diminuirá como ocorreria se a garrafa estivesse aberta. Será que isso significa, então, que a água não evapora se o recipiente estiver fechado?
Não. Todo sistema que contém um líquido está sujeito à evaporação. Isso acontece quando as moléculas da superfície ganham energia suficiente para desfazer as suas ligações intermoleculares e escaparem para fora da massa líquida.
Por exemplo, considere um sistema que contém uma parte de ar e outra de água, como na garrafa fechada. Inicialmente, algumas moléculas da superfície evaporam e ocupam os espaços entre as partículas de ar. Essa evaporação vai ocorrendo com várias moléculas separadas até que o ar fica saturado de vapor de água. Esse vapor de água exerce uma pressão sobre a superfície do líquido, sendo que essa é a pressão máxima de vapor da água nessa determinada temperatura.
Podemos chegar à seguinte definição:

A partir desse momento, o nível da água não se modifica, ou seja, a quantidade de moléculas no estado de vapor permanece constante. Entretanto, isso não significa que não haverá mais moléculas que passarão para o estado de vapor. Na realidade, para que uma molécula vire vapor, outra molécula que já está no estado de vapor deve voltar para o estado líquido e assim sucessivamente.
Quando o sistema atinge então a pressão máxima de vapor, significa que o sistema está em equilíbrio dinâmico. Para que uma molécula passe para o estado de vapor, outra deve se condensar.
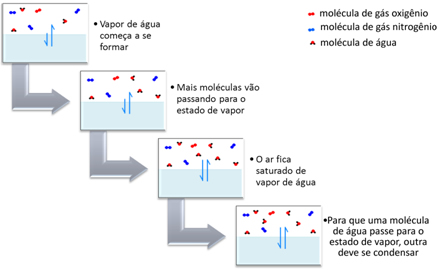
É por isso que o volume do líquido no recipiente fechado não sofre alteração. Essa informação também explica por que muitas vezes se formam pequenas gotículas de água em toda a superfície interna de uma jarra ou garrafa fechada que contém um pouco de água.
Ao contrário do que alguns possam pensar, não são só os líquidos que possuem pressão de vapor. Os sólidos também possuem, por exemplo, o gelo a -10ºC possui uma pressão de vapor igual a 2,149 mmHg.
A pressão de vapor depende de dois fatores: da natureza da substância e da temperatura. Para entender esse ponto, leia o texto “Fatores que alteram a pressão de vapor de um líquido”.

