Raio atômico: o tamanho do átomo
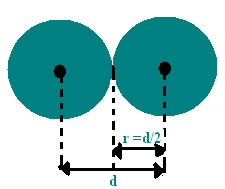
O raio atômico (r) é a metade da distância (d) entre dois núcleos de átomos vizinhos. Neste caso, considera-se o átomo como uma esfera. Então, de modo mais completo, podemos definir que o raio atômico (r) de um elemento é a metade da distância (d) internuclear mínima na qual dois átomos desse elemento podem estar, sem estarem ligados quimicamente. Utilizamos dois átomos não ligados, pois a medida do raio de um átomo isolado não pode ser feita com precisão, uma vez que a eletrosfera não tem um limite determinado.
Para realizar esta medida faz-se com que um feixe de raios-X atravesse a amostra de um material feito de átomos ou íons de um único elemento químico, sofrendo então um desvio. A imagem registrada sobre uma chapa fotográfica mostra a posição dos núcleos dos átomos e a distância (d) entre eles. Desse modo, é só dividir por dois este valor, que encontraremos o raio atômico deste elemento.
Por exemplo, a medida da distância entre os núcleos de dois átomos de ferro é 2,48 Å. Dividindo este valor por dois, obtemos o valor do raio do átomo de ferro que é de 1,24 Å.
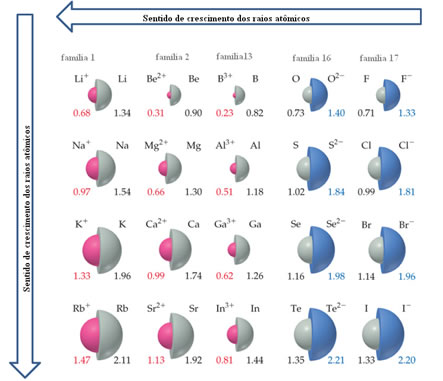
*Variação do raio atômico na Tabela Periódica:
a) Na mesma família: à medida que o número atômico aumenta (de cima para baixo), o raio atômico também aumenta. Isto ocorre porque os níveis de energia ou camadas eletrônicas do átomo no estado fundamental também aumentam. Assim, podemos dizer que o raio atômico cresce de cima para baixo na tabela periódica.
b) No mesmo período: neste caso, ocorre o inverso. À medida que o número atômico aumenta (da esquerda para a direita) em um mesmo período, o raio atômico diminui. Isto acontece porque, à medida que aumenta o número de prótons (carga nuclear), aumenta também a atração sobre os elétrons. Assim, diminui-se o tamanho dos átomos. Podemos confirmar, então, que o raio atômico cresce da direita para a esquerda na Tabela Periódica.