Reações de Oxidação de Alcenos
As reações de oxidação costumam ser lembradas por seu estudo em Físico-Química, como no caso das reações das pilhas, nos processo de eletrólise ou de corrosão dos metais. Porém, essas reações são importantes em vários outros campos da Química, como por exemplo, na Química Orgânica.
Elas podem ocorrem com os hidrocarbonetos e, mais especificamente, com os alcenos, de quatro formas diferentes, que são: combustão, ozonólise, oxidação branda e oxidação energética.
Mas, em todos os casos ocorre a perda de elétrons por uma espécie reagente (oxidação), simultaneamente ao ganho de elétrons por outra espécie (redução). Portanto, é necessário um agente oxidante, que será o oxigênio, e um agente redutor, que serão os átomos de carbonos envolvidos.
Veja como ocorre cada caso de oxidação de alcenos:
1. Combustão:
Nesse caso, o oxigênio é denominado de comburente e o alceno é o combustível. Existe a combustão completa e a incompleta. A completa ou oxidação total é a mais importante, sendo que seus produtos sempre serão dióxido de carbono (CO2) e água (H2O). O Nox do carbono passará a ser +4 no dióxido de carbono, que é o máximo possível para esse elemento.
Genericamente, a combustão completa para alcenos (fórmula geral: CnH2n) é dada por:
1 CnH2n + 3n/2 O2 → n CO2 + n H2O
Exemplo:
1 C8H16+ 12 O2 → 8 CO2 + 8 H2O
No caso da combustão incompleta, o oxigênio disponível é insuficiente, formando monóxido de carbono (CO) e água (H2O).
2. Ozonólise:
Como o próprio nome indica, o agente oxidante utilizado para romper a dupla ligação do alceno é o ozônio (O3). Quando a dupla ligação é quebrada, os carbonos passam a se ligar com os oxigênios do ozônio, produzindo o ozoneto (ou ozonídeo), que é instável e explosivo.
O ozonídeo, por sua vez, reage com água na presença de um agente redutor, como o zinco, e origina aldeídos e cetonas. Genericamente, temos:
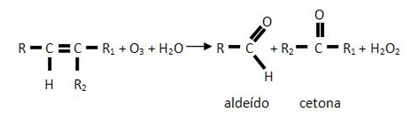
Exemplo:
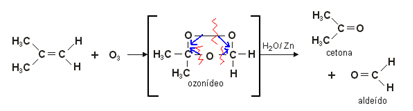
3. Oxidação branda:
A oxidação branda se dá com o uso de um reativo de Bayer, isto é, uma solução aquosa de permanganato de potássio diluída, neutra ou levemente básica, a frio, que se decompõe, originando oxigênio atômico. Esse oxigênio atuará como o agente oxidante, desfazendo a ligação pi da dupla ligação do alceno e se ligando aos carbonos. O produto será um diálcool (diol ou glicol).
.jpg)
3. Oxidação energética:
A diferença dessa oxidação para a anterior é que na oxidação energética a solução de permanganato de potássio está em meio ácido e a quente. Desse modo, a decomposição do permanganato, para originar o oxigênio atômico, se processa de modo mais energético.
Além disso, a oxidação do alceno também é mais energética, pois as duas ligações da ligação dupla são rompidas e os átomos de oxigênio se ligam ao carbono, podendo gerar os seguintes produtos:
- Se o carbono da dupla for terciário: o produto será uma cetona;
- Se o carbono da dupla for secundário: o produto será um ácido carboxílico;
- Se o carbono da dupla for primário: o produto será o ácido carbônico, que se decompõe em dióxido de carbono (CO2) e água (H2O).
Exemplo:
.jpg)

