Relações entre tipos de concentração das soluções

Existem vários tipos de concentração das soluções químicas, entre eles, temos:
·Concentração Comum
·Concentração em mol/L
·Densidade
·Título ou Porcentagem em massa de uma solução
As fórmulas usadas para calcular cada uma dessas concentrações são:

É importante lembrar que o índice 1 indica que a grandeza se refere ao soluto, índice 2 se refere ao solvente e quando não há índice, trata-se da solução. Por exemplo:
m1 = massa do soluto;
m2 = massa do solvente;
m = massa da solução (m1 + m2).
Podemos relacionar esses tipos de concentração das soluções e, dessa forma, chegar a novas fórmulas que podem ser usadas quando conveniente. Veja algumas dessas relações:
- Relação da concentração comum com o título:
C = m1 → m1 = C . V
V
T = m1 → m1 = T . m
m
C . V = T . m
C = T . m (I)
V
Da fórmula da densidade, temos:
d = m
V
Então, podemos fazer a seguinte substituição em (I):
C = T . d
É importante lembrar que a concentração comum (C) e a densidade devem estar nas mesmas unidades. Não pode acontecer, por exemplo, de a densidade estar em g/L e a concentração em g/cm3.
Agora temos uma nova fórmula que relaciona concentração comum, título e densidade. Veja um exemplo de exercício em que podemos usar essa relação:
Exemplo:
“Numa estação de tratamento de água, adicionou-se cloro até 0,4% de massa. A densidade da solução final era de 1,0 g/mL. Qual será a concentração de cloro nessa solução em g/L?”
Resolução:
Dados:
d = 1,0 g/mL
T = 0,4 %= 0,004
C = ? g/L
A primeira coisa que temos que fazer é igualar as unidades, passando a densidade de g/mL para g/L:
1000 mL = 1 L
1,0 g ---------- 1 mL
x -------------- 1000 mL
x = 1000 g → d = 1000 g/L
Agora usamos a fórmula que encontramos para descobrir a concentração comum:
C = T . d
C = 0,004 . 1000 g/L
C = 4 g/L
- Relação entre concentração comum e concentração em mol/L:
C = m1 → m1 = C . V
V
M = n1 → M = ___m1___ → m1 = MM1 . V . M
V MM1 . V
C . V = MM1 . V . M
C = MM1 . V . M
V
C = MM1 . M
Em que:
C = Concentração comum;
MM1= massa molar do soluto;
M = concentração em mol/L (molaridade).
Exemplo:
“Determine a concentração em mol/L e em g/L de 30g de ácido acético presente em cada 5L de vinagre (H3CCOOH). (Massa molar do H3CCOOH = 60 g/mol).”
Resolução:
Dados:
m1 = 30g
V = 5 L
MM1 = 60 g/mol
C = ? g/L
M = ? mol/L
Podemos encontrar o valor da concentração comum pela sua fórmula básica:
C = m1
V
C = 30g
5L
C = 6 g/L
Agora podemos usar a relação abaixo para encontrar o valor da concentração em mol/L:
C = MM1 . M
M = __C__
MM1
M = __6 g/L __
60 g/mol
M = 0,1 mol/L
Podemos estabelecer o seguinte também:
C = MM1 . M
C = T . d
MM1 . M = T . d
Vamos usar essa relação para resolver mais um exercício:
Exemplo:
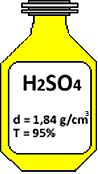
“O ácido sulfúrico (H2SO4) é um reagente muito importante para trabalhos desenvolvidos em laboratório. Observe o frasco abaixo e indique qual é a concentração em mol/L desse ácido sulfúrico. (Massa molar do H2SO4= 98 g/mol).”
Resolução:
Dados:
d = 1,84 g/cm3
T = 95% = 0,95
MM1 = 98 g/mol
M = ? mol/L
Primeiro temos que passar a densidade para g/L. Se 1 cm3 = 1 mL e 1000 mL = 1 L, então: 1000 cm3 = 1 L:
1,84 g---------- 1 cm3
x -------------- 1000 cm3
x = 1840 g → d = 1840 g/L
Agora usamos a relação encontrada para descobrir o valor da concentração em mol/L:
MM1 . M = T . d
M = T . d
MM1
M = 0,95 . 1840 g/L
98 g/mol
M = 1748 g/L
98 g/mol
M = 17,8 mol/L
Ferramentas Brasil Escola


Últimas notícias
Outras matérias



















