Solubilidade e Saturação
Existem três tipos de soluções que podemos preparar quanto à saturação, que são: insaturada, saturada e supersaturada. Porém, antes de explicarmos cada uma delas, é necessário saber alguns termos que serão usados na explicação desse conteúdo:
- Soluto: substância dissolvida pelo solvente. Por exemplo, na mistura de água e sal, o sal é o soluto;
- Solvente: substância que dissolve o soluto. No exemplo citado no item anterior, a água é o solvente;
- Solução: misturas homogêneas de duas ou mais substâncias, isto é, de aspecto uniforme. Exemplos: água e sal, água e álcool, água e açúcar, ligas metálicas, o ar, etc.;
- Corpo de chão, corpo de fundo ou precipitado: é a parte de soluto que não se dissolve no solvente e fica no fundo do recipiente;
- Coeficiente de solubilidade: é a medida da capacidade que um soluto possui de se dissolver numa quantidade-padrão de um solvente, em determinadas condições de temperatura e pressão. Em outras palavras, é a quantidade máxima que pode ser dissolvida de soluto numa dada quantidade de solvente, a uma determinada temperatura e pressão.
Por exemplo, a 20°C, a quantidade máxima de sal de cozinha (Cloreto de Sódio – NaCl) que se dissolve em 100 gramas de água é 36 g. Logo, dizemos que o coeficiente de solubilidade do NaCl é: 36g NaCl/100 g de água a 20ºC.
Esteja atento a esse exemplo, pois ele será usado em todo o texto.
Sabendo esses conceitos, podemos agora definir cada uma das soluções citadas anteriormente:
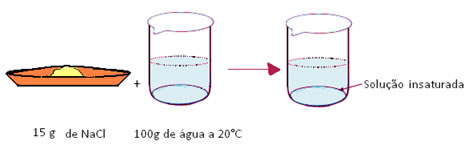
- Soluções insaturadas ou não saturadas: são aquelas em que a quantidade de soluto dissolvido ainda não atingiu o coeficiente de solubilidade. Isso significa que se quisermos dissolver mais soluto, isso será possível.
Por exemplo, se dissolvermos apenas 15 g de sal em 100 g de água a 20ºC, teremos uma solução insaturada, pois ainda faltam 21 g para atingir a quantidade máxima de soluto a ser dissolvido nessas condições.
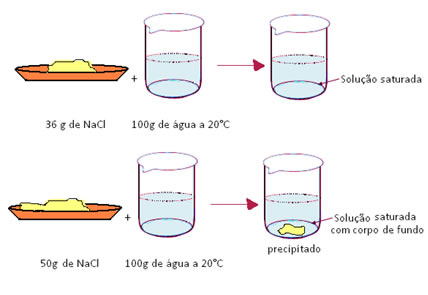
- Soluções saturadas: são aquelas que atingiram exatamente o coeficiente de solubilidade.
Se misturarmos 50g de sal em 100 g de água a 20ºC, veremos que os 36g irão se dissolver e o restante (14g) irá precipitar, formando corpo de fundo. Nesse caso teremos então uma solução saturada com corpo de fundo. Porém, se quisermos apenas a solução saturada, basta realizar uma filtração simples para separar o precipitado da solução saturada.
- Soluções supersaturadas: possuem mais soluto dissolvido do que seria possível em condições normais.
Por exemplo, se pegarmos a solução saturada com corpo de fundo, citada anteriormente, que possui 36g de sal dissolvidos e 14 g no corpo de fundo, e a aquecermos, notaremos que os 14 g que estavam precipitados irão se dissolver. Isso acontece porque com o aumento da temperatura o coeficiente de solubilidade, nesse e na maioria dos casos, também aumenta. Posteriormente, deixamos essa solução em repouso para que volte à temperatura inicial, que era de 20°C. Ao fazermos isso, os 50g continuam dissolvidos na água. Desse modo, haverá mais soluto dissolvido (50g) do que deveria ter (36g) naquela temperatura e pressão. É, portanto, um caso de solução supersaturada.
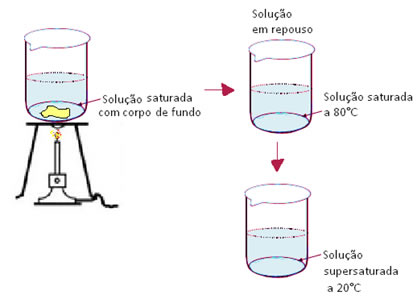
No entanto, esse tipo de solução é muito instável. Agitando-a ou adicionando a ela um pequeno cristal de NaCl, ocorrerá a precipitação dos 14 g de sal.

