Influência da Concentração na Velocidade das Reações

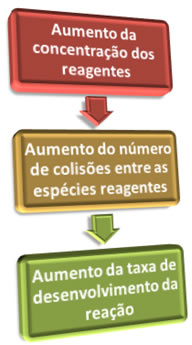
Entre os principais fatores que alteram a velocidade das reações está a concentração dos reagentes. Geralmente, um aumento na concentração dos reagentes aumenta a rapidez de uma reação.
Por exemplo, na figura acima vemos que uma palha de aço queima de forma moderada quando está em contato com o ar. Isso ocorre porque é necessário gás oxigênio (O2) para que ela entre em combustão. No entanto, apenas 20% do ar é constituído de moléculas de oxigênio. Já na segunda imagem vemos que a palha de aço está queimando com uma velocidade muito maior, sendo que ela foi colocada em um frasco contendo gás oxigênio puro.
Portanto, aumentou-se a concentração do gás oxigênio de 20% para 100%, o que nos permite concluir que o aumento na concentração do reagente aumentou a velocidade da reação.
Outro exemplo, que pode ser visto na figura abaixo, é quando colocamos o zinco em uma solução diluída de ácido sulfúrico e em uma solução concentrada. Veja que o zinco que está na solução concentrada de ácido sulfúrico reage muito mais rapidamente:

Mas, por que a concentração influencia dessa forma na velocidade das reações?
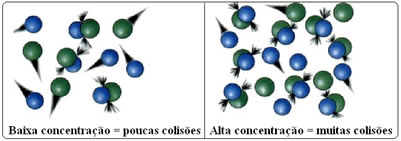
Bom, conforme visto no texto “Teoria das colisões”, para que uma reação se efetive é necessário que ocorram choques ou colisões eficazes entre os átomos dos reagentes. Assim, quando aumentamos a sua concentração haverá uma maior quantidade de moléculas presentes no sistema em um mesmo espaço, o que acarretará em aumento nas suas colisões em um mesmo intervalo de tempo e, consequentemente, uma maior probabilidade de ocorrerem choques efetivos ou eficazes.
Isso pode ser visualizado na figura abaixo, onde se comparando o primeiro sistema com o segundo é possível constatar que o aumento da concentração dos reagentes faz com que haja mais moléculas e mais colisões, aumentando a rapidez da reação.
Dessa forma, resumidamente, temos:
Embora essa seja uma constatação que se repete para a maioria dos casos, é necessário fazer os cálculos experimentais para determinar a influência da concentração específica em cada reação, pois, em alguns casos, se dobrarmos a concentração dos reagentes a rapidez da reação também dobra, já em outros casos quadriplica e, ainda em outras reações, a velocidade permanece constante.
Além disso, em sistemas gasosos, quando se aumenta a pressão é o mesmo que aumentar a concentração, pois haverá um menor espaço ou volume para as moléculas do que havia no sistema anterior ao aumento da pressão.
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















