Titulação ácido-base
Quando os cientistas precisam determinar a concentração em mol/L (em quantidade de matéria) de alguma solução, costuma-se usar uma técnica de análise volumétrica denominada titulação, ou mais especificadamente, titulação ácido-base.
Esse método é feito colocando-se para reagir uma solução a qual se sabe a concentração, que é denominada de titulante, com a solução a qual não se sabe a concentração, que é denominada de titulado. Uma dessas soluções é uma base, enquanto a outra é um ácido.
A reação que ocorre entre um ácido e uma base é denominada neutralização, pois o pH costuma ficar neutro ou próximo disso, o que equivale a um pH igual a 7. Quando um ácido reage com uma base, água e um sal são formados. É preciso saber equacionar esse tipo de reação para os cálculos usados na titulação, conforme será mostrado mais adiante.
Com a adição de um indicador ácido-base, observa-se quando a reação se completa, atingindo o ponto de equivalência ou ponto de viragem. É possível saber quando isso ocorre e parar a reação, porque a cor da solução sofre uma mudança brusca na presença de um indicador ácido-base, em virtude da variação do pH.
No entanto, embora o ponto de equivalência indique o térmico da titulação, nem sempre os volumes das soluções que são utilizadas resultam em uma solução final neutra, com pH igual a 7.
Veja o passo a passo de como costuma ser feita uma titulação ácido-base em laboratório:
- Com o auxílio de uma pipeta, transfere-se um volume conhecido do titulado para um erlenmeyer;
- Adicionam-se poucas gotas de algum indicador ácido-base, como a fenolftaleína, ao titulado;
- Completa-se o volume de uma bureta com a solução titulante;

- Monta-se uma aparelhagem semelhante à mostrada abaixo:
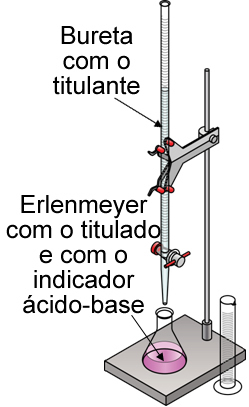
- Inicia-se a reação abrindo vagarosamente a torneira da bureta para que, gota a gota, o titulante caia sobre o titulado. Enquanto uma das mãos permanece sobre a torneira (para que, se for preciso, ela seja fechada imediatamente), a outra mão fica agitando o erlenmeyer para que a reação ocorra em toda a extensão da solução que está sendo titulada;
Na imagem abaixo, temos um balão de fundo chato no lugar do erlenmeyer:

- Quando a cor do titulado muda bruscamente, fecha-se a torneira da bureta, pois a reação se completou;
Por exemplo, se o indicador usado foi a fenolftaleína e o titulado era inicialmente uma solução de ácido clorídrico (HCl), a solução com o indicador estava incolor. Mas, no ponto de viragem, a solução passa para a cor rosa.
- Agora, basta ler o volume de titulante que foi necessário para neutralizar o titulado, equacionar a reação que ocorreu e, com os outros dados em mãos, fazer as contas para descobrir a concentração do titulado.
- Cálculos para determinar a concentração do titulado:
Por exemplo, digamos que colocamos 5 mL do titulado, sendo uma solução de HCl de concentração desconhecida no erlenmeyer, e usamos como titulante uma solução básica de NaOH, com concentração conhecida de 0,1 mol/L. Ao final da titulação, lemos na bureta que o volume gasto da solução de NaOH foi de 50 mL.
Portanto, nossos dados são:
MHCl = ?
MNaOH = 0,1 mol/L
VNaOH = 50 mL = 0,05 L
VHCl = 5,0 mL = 0,005 L
A reação de neutralização que ocorreu foi a seguinte:
HCl + NaOH → NaCl + H2O
Veja que a proporção estequiométrica é de 1 : 1, ou seja, uma molécula de ácido reage com exatamente uma de base: nHCl =nNaOH .
Sendo M = n/V → n = M . V, temos a seguinte relação:
MHCl . VHCl = MNaOH . VNaOH
MHCl . 0,005 L = 0,1 mol/L . 0,05 L
MHCl = 0,005 mol
0,005 L
MHCl = 1,0 mol/L
Portanto, a concentração inicial da solução de HCl, nosso titulado, era de 1,0 mol/L.