Análise Gráfica da Velocidade das Reações
A Cinética Química é o estudo da velocidade, rapidez ou taxa de desenvolvimento de uma reação química e dos fatores que influenciam esse processo. Assim, nesse estudo é extremamente necessária a análise gráfica das reações, tanto do ponto de vista do consumo dos reagentes, quanto da formação dos produtos.
Portanto, para que você possa prosseguir em seus estudos da Cinética Química, entenda como realizar esse estudo gráfico observando os exemplos a seguir:
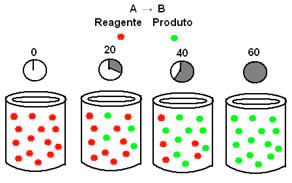
Considere primeiramente uma reação genérica que se processa da forma mais simples possível, isto é, um único reagente (A) se transforma em um único produto (B). A reação dura 1 hora, ou 60 minutos, segundo o esquema abaixo:
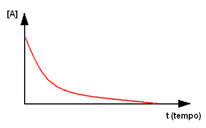
Conforme se pode ver nesse exemplo, em geral, no início da reação, a quantidade de reagente é máxima, mas com o passar do tempo ele vai sendo consumido e sua concentração no sistema vai diminuindo até que acabe por completo. Isso pode ser expresso por meio de um gráfico que relaciona o tempo transcorrido e a concentração do reagente:
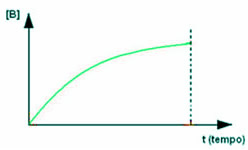
O processo inverso ocorre com o produto, que inicialmente tem uma concentração de zero, pois ainda não começou a ser formado. Mas quando o reagente começa a reagir, a concentração do produto passa a aumentar gradativamente com o decorrer do tempo, até que, no final da reação, torna-se máxima:
A concentração é representada por colchetes com a fórmula da substância dentro ([]) e normalmente a unidade é dada em mol/L. Além disso, o que se costuma fazer é colocar em um único gráfico todas as variações de concentração com o tempo:
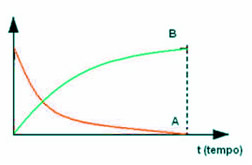
Vejamos como isso se dá com uma reação em que há mais de um reagente, como a descrita abaixo:
1 H2(g) + 1 I2(g) → 1 HI(g)
Observe a tabela a seguir, que apresenta valores específicos das variações das concentrações dos reagentes e dos produtos com o passar do tempo:
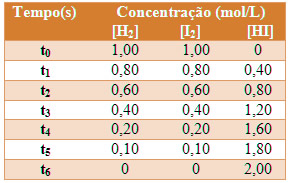
Transpondo esses valores para um único gráfico que relaciona a variação da concentração em mol/L pelo tempo, teremos:
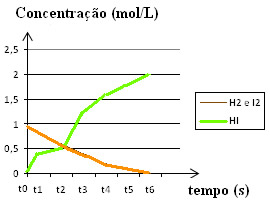
Se fizermos um gráfico de velocidade ou taxa de desenvolvimento da reação em função do tempo para uma reação genérica, veremos que o resultado será uma curva:
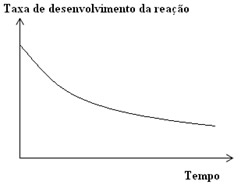
No exemplo citado, a concentração dos dois reagentes variou por igual. Mas agora vejamos um último exemplo, no qual temos apenas um reagente, o peróxido de hidrogênio em solução aquosa, que é a água oxigenada, decompondo-se para formar dois produtos, o gás oxigênio e a água:
2 H2O2(aq) → 2 H2O (l) + 1 O2(g)
Observe que nesse caso a proporção não é a mesma para todos, mas sim de 2:2:1. Por isso, teremos variações de concentrações diferentes. A seguir temos a tabela que relaciona alguns dados experimentais dessa variação:
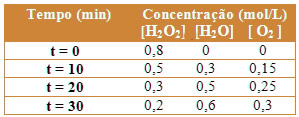
Com base nos dados, teremos o seguinte gráfico para representar as variações das concentrações das três substâncias no decorrer do tempo:
.jpg)
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias



















