Soluções
Soluções são misturas de duas ou mais substâncias que estão em apenas uma fase de agregação (sólido, líquido ou gasoso) e apresentam um aspecto uniforme e homogêneo. As soluções são formadas por substâncias dissolvidas, denominadas solutos, em um solvente, que está presente em maior quantidade.
No nosso cotidiano, estamos em constante contato com soluções, como as ligas metálicas, o ar atmosférico, o soro fisiológico, entre outras. Em várias dessas soluções formadas por sólidos e líquidos, a água atua como solvente na maioria dos casos e, por isso, é considerada um solvente universal.
Saiba mais: Água como solvente
Tipos de soluções
As soluções podem ser classificadas de acordo com o estado físico em que se encontram à temperatura ambiente, sendo essa denominação dada em: sólidas, líquidas ou gasosas.
→ Sólidas: Em temperatura ambiente, os componentes da solução encontram-se no estado sólido. Chamamos a esse tipo de solução por ligas. Um exemplo dessas ligas é o ouro 18k e o bronze (estanho + cobre).

→ Gasosas: Nesse tipo de solução, os componentes estão no estado gasoso. Toda mistura gasosa é uma solução. Como exemplo temos o ar atmosférico, que é composto por 78% de N2, enquanto O2, CO2 e gases nobres completam os outros 28%.
→ Líquidas: Para as soluções líquidas, basta que apenas um dos componentes esteja no estado líquido. Normalmente pensamos em um sólido dissolvido em um líquido, mas existem outras possibilidades que resultam em uma solução líquida. Vejamos algumas delas.
- Solução formada por líquidos: Nesse caso, um líquido é dissolvido em outro. Como exemplo temos o álcool comercial, que é uma mistura de água e álcool etílico.
Leia também: Processo de produção do álcool
- Solução formada por sólidos e líquidos: Em nosso dia a dia, esse tipo de solução é o mais comum, principalmente quando estamos falando de sólidos dissolvidos em água. O soro fisiológico e a água sanitária são soluções aquosas de cloreto de sódio (NaCl) e hipoclorito de sódio (NaClO), respectivamente.
- Solução formada por gases e líquidos: Podemos citar a bebida gaseificada como exemplo em nosso cotidiano de substância no estado gasoso dissolvida em um líquido. A solubilidade do gás no líquido depende, principalmente, de dois fatores: pressão e temperatura.
Saiba mais: Óxidos em bebidas gaseificadas
- Influência da pressão: O estudo do efeito da pressão sobre a solubilidade dos gases foi realizado pelo químico britânico William Henry, que descobriu que “a solubilidade de um gás em um líquido é diretamente proporcional à pressão do gás sobre o líquido”. Esse efeito ficou conhecido como a Lei de Henry.
- Influência da temperatura: A solubilidade de um gás em um líquido é inversamente proporcional à sua temperatura, ou seja, quanto maior a temperatura em que se encontra a solução, menor será a solubilidade do gás.
Coeficiente de solubilidade
O coeficiente de solubilidade (CS) determina a quantidade máxima possível de um soluto que podemos dissolver em uma certa quantidade de solvente, a uma determinada temperatura.
Cada substância apresenta um comportamento diferente ao ser solubilizada em um solvente, algumas apresentam uma baixa solubilidade em água, já outras apresentam altos coeficientes de solubilidade.
Temos substâncias que aumentam a solubilidade com o aumento da temperatura e substâncias que se tornam menos solúveis. Além disso, é importante lembrar que uma mesma substância apresenta coeficientes de solubilidades diferentes em diferentes solventes.
A solubilidade do cloreto de sódio (NaCl), por exemplo, é de 36 gramas de sal em 100 gramas de água a 20ºC, ou da forma como escrevemos o coeficiente: 36 g de NaCl/100 g de H2O a 20ºC. Para efeito de comparação, o coeficiente do cloreto de prata (AgCl) é de 0,0014 g de AgCl/100 g de H2O a 20ºC, bem abaixo da solubilidade do NaCl.
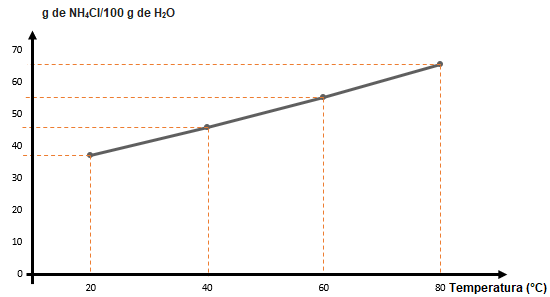
O coeficiente de solubilidade pode ser representado em tabelas ou gráficos. Para demonstrá-lo nessas formas, vamos analisar a solubilidade do cloreto de amônio (NH4Cl):
|
CS de NH4Cl (g/100 g de H2O) |
Temperatura (ºC) |
|
37,2 |
20 |
|
45,8 |
40 |
|
55,2 |
60 |
|
65,6 |
80 |
Com os dados da tabela, podemos representar o coeficiente do NH4Cl graficamente:
Concentração das soluções
Quando trabalhamos com soluções, além de conhecer bem os componentes envolvidos em cada uma, é necessário saber a quantidade de soluto em determinada quantidade de solvente. Para isso usamos a concentração das soluções, que pode ser expressa de diferentes formas usando diferentes unidades. As principais relações de concentração estão listadas a seguir:
-
Concentração comum ou concentração em massa: relaciona a massa do soluto dissolvido em determinado volume de solução. Normalmente é expressa em gramas por litro (g/L):
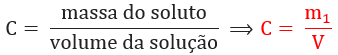
-
Concentração em quantidade de matéria ou concentração molar: relaciona a quantidade de matéria do soluto presente em determinado volume de solução. No sistema internacional, sua unidade é dada em mol por litro (mol/L):
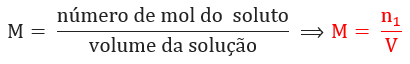
-
Densidade: é a relação entre a massa da solução e seu volume. Ela pode ser expressa em diversas unidades, tais como: g/L, g/mL, g/cm3, kg/m3 etc.
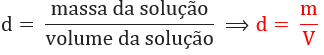
-
Título: pode ser usado como título em volume (τv), que relaciona o volume do soluto e o volume da solução. Ou, ainda, como título em massa (τm), que faz a relação entre a massa de soluto e a massa da solução.

Diluição das soluções
A diluição de soluções — um fenômeno bastante comum tanto em nosso cotidiano quanto nos laboratórios — consiste em adicionar mais solvente à solução, a fim de diminuir sua concentração, obtendo assim uma solução mais diluída.
Durante uma diluição, a quantidade de soluto não muda, apenas a quantidade de solvente sofre alteração. Assim sendo, a quantidade de soluto no início sempre será igual a sua quantidade final.
Com essa informação, podemos estabelecer relações com as concentrações iniciais e finais das soluções:

Se m1 = m1, então:
![]()
Seguindo o mesmo raciocínio, podemos estabelecer as seguintes relações para os outros tipos de concentração:
-
Concentração mol/L
![]()
-
Título
![]()
Exercícios resolvidos
Questão 01 (PUC-Camp-SP) Os xaropes são soluções concentradas de açúcar (sacarose). Em uma receita caseira, são utilizadas 500 g de açúcar para cada 1,5 L de água. Nesse caso, a concentração mol/L de sacarose nesse xarope é de, aproximadamente,
Dado: Massa molar da sacarose = 342 g/mol
a) 2,5
b) 1,5
c) 2,0
d) 1,0
e) 3,0
Resolução: Letra d. Para calcular a concentração em mol/L do xarope, precisamos primeiro encontrar a quantidade em mol contida em 500 g de sacarose usando a massa molar:
342 g --------- 1 mol
500 g --------- X
342 . X = 500
X = 1,5 mol
Agora podemos usar a fórmula da concentração molar:
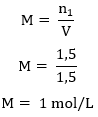
Questão 02 (UCB-DF) Em determinado exame clínico utilizado para medir a intolerância a carboidratos, um adulto deve beber 200 mL de uma solução de glicose a 30% (70% de água e 30% de glicose). Quando uma criança é submetida a esse exame, a concentração de glicose deve ser reduzida para 20%. Quantos mililitros de água devem ser adicionados a 200 mL de uma solução de glicose a 30%, para preparar-se uma solução de glicose a 20%?
a) 150
b) 80
c) 120
d) 100
e) 50
Resolução: Letra d. Para encontrar o volume de água que deve ser adicionada à solução, usaremos a fórmula de diluição:
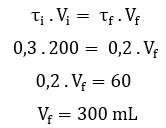
O volume da solução dever ser 300mL para preparar uma solução de glicose a 20%, portanto, devem ser adicionados 100 mL ao volume inicial (200 + 100 = 300 mL).
