Mudanças de fases
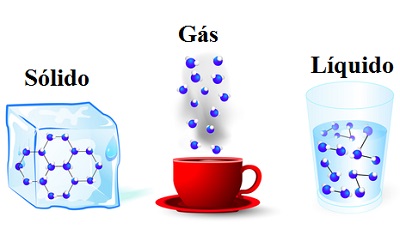
As substâncias podem ser encontradas na natureza em três estados físicos, são eles: sólido, líquido e gasoso. Eles também podem ser chamados de fases da matéria ou estados de agregação da matéria. A diferença entre os três estados está relacionada com as características moleculares das substâncias.
No estado sólido, os átomos ou moléculas que constituem uma substância encontram-se bem unidos em virtude da existência de forças elétricas intensas agindo sobre eles. Além disso, os átomos que formam essas substâncias possuem uma estrutura cristalina de forma bastante regular, e essa estrutura repete-se. A energia das moléculas é baixa e elas mantêm-se praticamente em repouso.
Os líquidos, por sua vez, apresentam forças de ligação menos intensas do que os sólidos, o que faz com que as moléculas fiquem mais afastadas umas das outras e movimentem-se mais livremente, portanto elas possuem maior energia. Isso explica porque a matéria no estado líquido pode escoar e ocupar o volume do recipiente que a contém.
No estado gasoso, praticamente inexiste força de ligação entre os átomos, que ficam separados uns dos outros por distâncias bem superiores às dos sólidos e líquidos. Os gases também possuem muito mais energia e movimentam-se desordenadamente, podendo ser facilmente comprimidos. Além disso, assumem a forma e volume do recipiente em que são colocados.
Mudanças de fases
Para que ocorram mudanças de fases da matéria, é necessário ceder ou retirar calor de um corpo. O calor é a energia térmica que determina o grau de agitação das moléculas. Ao ser alterado, ele pode causar mudanças no arranjo molecular das substâncias, causando as mudanças de fase. Os nomes dados às mudanças de fase dependem dos estados inicial e final das substâncias.
Observando essas características, as mudanças de fase são as seguintes:
-
Fusão: passagem do estado sólido para o líquido ( Ex.: transformação do gelo em água). Ela ocorre quando a substância sólida recebe energia térmica (calor), aumentando sua agitação molecular e vencendo as fortes interações atômicas, ou moleculares, existentes no estado sólido.
-
Solidificação: mudança do estado líquido para o sólido (Ex.: congelamento da água). Para que ocorra a solidificação, a substância deve perder energia, o que faz com que as vibrações moleculares diminuam e fiquem mais unidas.
Veja o diagrama a seguir que demonstra a fusão e a solidificação:
.jpg)
Diagrama demonstrando a fusão e a solidificação
-
Vaporização: ocorre quando uma substância no estado líquido é aquecida. A energia recebida causa aumento na agitação molecular e as moléculas separam-se umas das outras, passando para o estado gasoso.
-
Condensação: passagem do estado gasoso para o líquido. É a forma como ocorrem as chuvas. A água que evapora na superfície da Terra chega a grandes altitudes e, quando entra em contato com ar frio na atmosfera, volta ao estado líquido.
O diagrama a seguir demonstra como ocorrem essas mudanças de fase:

Diagrama demonstrando a vaporização e a condensação
-
Sublimação: consiste na passagem do estado sólido para o gasoso diretamente, sem antes passar pelo estado líquido. Esse fenômeno explica porque a naftalina “some”, produzindo o vapor tóxico utilizado para espantar pequenos insetos, como as baratas. O que ocorre, na verdade, é a sublimação, ou seja, a transformação direta em gás.
-
Cristalização: mudança do estado gasoso para o sólido, também sem antes passar por líquido.

Diagrama demonstrando a sublimação e a cristalização
Neste texto, consideramos apenas a temperatura nas mudanças de fases e a pressão constante. Entretanto, a pressão também influencia as mudanças de fases das substâncias, uma vez que, quanto maior a pressão, mais unidas ficam as moléculas, o que dificulta mudanças na estrutura molecular ou na movimentação dos átomos que as constituem, dificultando também as mudanças de fases.