Calor
Calor é a energia transmitida espontaneamente entre corpos que se encontram em diferentes temperaturas. Por tratar-se de uma forma de energia, o calor é expresso em Joules, entretanto, por razões históricas, é comum que utilizemos a caloria como uma unidade de medida alternativa para medidas de calor.
O calor pode ser transferido entre diferentes sistemas termodinâmicos por meio dos processos de condução, convecção e radiação. Além disso, de acordo com a Lei Zero da termodinâmica, o calor só pode fluir de maneira espontânea entre corpos que apresentem alguma diferença de temperatura.

Tipos de calor
-
Calor sensível
O calor sensível é o tipo de calor que está presente em processos que apresentam variações de temperatura. O calor sensível é diretamente proporcional à variação de temperatura, isto é, quanto maior for a quantidade de calor recebida por um corpo, maior será o aumento de temperatura. Confira a fórmula utilizada para o cálculo do calor sensível:
![]()
Q - calor (J ou cal)
m - massa (kg ou g)
c - calor específico (cal/gºC ou K/kg.K)
ΔT - variação de temperatura (K ou ºC)
Na fórmula exibida, c é chamado de calor específico. O calor específico é uma grandeza microscópica que mede a quantidade de calorias necessária para aquecer, em 1 ºC, uma massa de 1 g de alguma substância pura, em condições normais de pressão e temperatura (1 atm, 25 ºC). Adota-se a água pura como referência para a determinação do calor específico das demais substâncias. O calor específico da água é de 1,0 cal/gºC.
-
Calor latente

Calor latente é a quantidade de calor relacionada às mudanças de estado físico. Quando alguma substância pura atinge as temperaturas de fusão ou ebulição, sua temperatura permanece constante. No entanto, essa substância continua a absorver calor. Essa quantidade de calor, que é absorvida durante a transição de estados físicos, é chamada de calor latente. A fórmula utilizada para o cálculo do calor latente é esta:
![]()
Q - calor (J ou cal)
m - massa (kg ou g)
L - calor latente (J/kg ou cal/g)
Propagação de calor
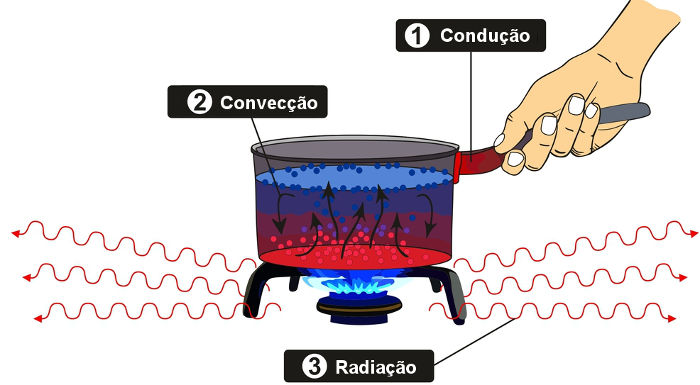
O calor pode propagar-se por três meios distintos: condução, convecção e radiação. Vamos descrever cada um desses processos a seguir:
- Condução: ocorre principalmente em meios sólidos. Nesse processo, há condução de calor sem transporte de matéria.
- Convecção: acontece em meios fluidos, como líquidos e gases. Nesse processo, uma diferença de temperatura faz com que se formem correntes de convecção, até que todo o sistema passe a exibir a mesma temperatura.
- Radiação: é a transmissão de calor por ondas eletromagnéticas. A radiação não necessita de um meio físico, por isso é o único dos processos de transmissão de calor que pode ocorrer no vácuo.
Calor e temperatura
Apesar de usarmos as palavras calor e temperatura em contextos parecidos, essas duas grandezas físicas são completamente diferentes. O calor é uma forma de energia, enquanto a temperatura é uma medida do grau de agitação das moléculas de um sistema.
Enquanto o calor é medido em Joules, ou em calorias, a temperatura é medida em Kelvin ou em graus Celsius. A confusão em torno desses conceitos deve-se principalmente à nossa língua: quando dissemos que “está calor”, estamos na verdade referindo-nos a uma temperatura elevada.
Exercícios resolvidos sobre calor sensível e calor latente
1) Um copo de vidro contém 100 g de água à temperatura de 25 ºC. Ao ser colocado no interior de uma geladeira, verifica-se que, após alguns minutos, sua temperatura é de 10 ºC. Considerando a capacidade térmica do copo de vidro desprezível, a quantidade de calor cedida pela água do copo no interior da geladeira é igual a
Dados: c = 1,0 cal/gºC
a) 1500 cal.
b) -1500 cal.
c) - 1,5 cal.
d) 15 cal.
e) 25 cal.
Gabarito: Letra B
Resolução:
Para resolvermos a questão, é necessário perceber que o processo descrito envolve a troca de calor sensível, uma vez que há variação de temperatura. Por isso, utilizaremos a fórmula do calor sensível:
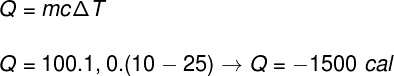
O sinal negativo encontrado na resolução deve-se ao fato de que a água cedeu calor e, por isso, resfriou-se. Dessa forma, a alternativa correta é a letra B.
2) Sabe-se que o calor latente de fusão da água é igual a 80 cal/g, enquanto o calor latente de fusão do chumbo é de 6 cal/g. Em relação a esse dado, assinale a alternativa correta.
a) Durante o processo de fusão, o chumbo derrete mais lentamente que o gelo.
b) Durante o processo de fusão, o chumbo derrete mais rapidamente que o gelo.
c) O gelo precisa de uma menor quantidade de calor latente para derreter.
d) O chumbo necessita de uma menor quantidade de calor para fundir-se, se comparado ao gelo.
e) O gelo e o chumbo precisam absorver aproximadamente a mesma quantidade de calor para que se fundam.
Gabarito: Letra D
Resolução:
Vamos analisar as alternativas:
a) FALSO: O tempo necessário para que a fusão ocorra não depende EXCLUSIVAMENTE do calor latente de fusão dessas substâncias, mas sim da potência da fonte de calor.
b) FALSO: Igual ao item anterior.
c) FALSO: O calor latente de fusão do gelo é muito maior que o calor latente de fusão do chumbo, por isso, esse último precisa absorver menos calor para derreter.
d) VERDADEIRO
e) FALSO: Comparativamente, o gelo necessita de uma quantidade de calor muito maior para fundir-se.
