Volatilidade na Química
Volatilidade na Química é a facilidade com que uma substância passa para o estado gasoso, ou seja, sua tendência de evaporar. Esse fenômeno está intimamente ligado à pressão de vapor — a pressão exercida pelas moléculas de uma substância em estado gasoso quando em equilíbrio com sua fase líquida. Entre as substâncias voláteis mais conhecidas, destacam-se a acetona, o éter e a gasolina.
A volatilidade é influenciada por diversos fatores, como a temperatura, a pressão, a massa molecular e as forças intermoleculares. Por exemplo, substâncias com forças intermoleculares fracas, como os compostos apolares, são mais voláteis. Compreender a volatilidade é essencial em diferentes áreas, como Química industrial, farmacêutica e ambiental, pois ela impacta a manipulação, o armazenamento e o transporte de substâncias químicas.
Leia também: Quais são os três estados físicos da matéria?
Resumo sobre volatilidade na Química
- A volatilidade na Química é a facilidade que uma substância apresenta para passar ao estado gasoso.
- A volatilidade de uma substância não pode ser calculada por meio de fórmulas, mas pode ser relacionada pela pressão de vapor.
- São exemplos de líquidos voláteis: éter etílico, acetona, água e etanol.
- São exemplos de líquidos não voláteis: glicerina, óleos em geral e mercúrio.
- A volatilidade está relacionada com a pressão de vapor — a pressão exercida pelas moléculas de um líquido que escapam para o estado gasoso e entram em equilíbrio dinâmico com o líquido.
O que é volatilidade na Química?
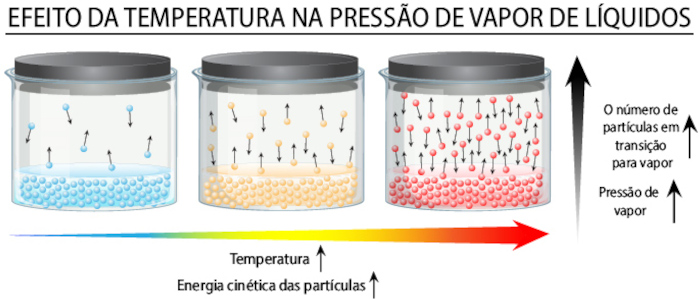
A volatilidade na Química é a facilidade que uma substância apresenta ao passar para o estado gasoso. Essa característica pode ocorrer com substâncias no estado sólido ou líquido. A volatilidade é dependente de alguns fatores, como forças intermoleculares, temperatura, pressão e massa molecular:
- Forças intermoleculares: quanto mais fracas forem as forças intermoleculares, maior será a volatilidade da substância. Saiba mais sobre essas forças clicando aqui.
- Temperatura: à medida que a temperatura aumenta, as moléculas de uma substância ganham energia cinética suficiente para superar as forças de coesão, aumentando a volatilidade.
- Pressão: a pressão é a força exercida por moléculas sobre uma superfície. Em ambientes de baixa pressão atmosférica, as moléculas de um líquido conseguem escapar com mais facilidade, aumentando a volatilidade.
- Massa molecular: substâncias com menor massa molecular tendem a ser mais voláteis, pois suas moléculas têm menor inércia e se movimentam mais facilmente, favorecendo a passagem para o estado gasoso.
Tabela de volatilidade química
Como mencionado anteriormente, a volatilidade de uma substância aumenta de acordo com a temperatura a que ela é submetida. A volatilidade de uma substância é expressa por meio da pressão de vapor, que dependerá do nível de pureza da substância, como mostra a tabela abaixo.
|
Nome da substância |
Temperatura de referência (°C) |
Pressão de vapor (mmHg) |
|
Acetona |
20 |
175 |
|
Ácido clorídrico (32%) |
20 |
16 |
|
Ácido nítrico (65%) |
20 |
7 |
|
Ácido sulfúrico (98%) |
20 |
0,0001 |
|
Água |
20 |
18 |
|
Água |
50 |
90 |
|
Água |
100 |
760 |
|
Água oxigenada (70%) |
30 |
2 |
|
Água oxigenada (50%) |
30 |
1 |
|
Etanol (hidratado 93%) |
38 |
96 |
|
Etanol (hidratado 93%) |
20 |
44 |
|
Etanol (hidratado 70%) |
20 |
44 |
|
Formol (37%) |
40 |
4 |
|
Gasolina |
38 |
441 |
|
Mercúrio |
20 |
0,001 |
|
Óleo combustível |
40 |
<1 |
|
Óleo lubrificante |
20 |
<5 |
|
Querosene |
38 |
11 |
Como calcular a volatilidade?
A volatilidade de uma substância não pode ser diretamente calculada por uma fórmula, mas pode ser medida indiretamente por meio da pressão de vapor. Em geral, quanto maior a pressão de vapor de uma substância em determinada temperatura, maior será sua volatilidade.
Entretanto, em soluções, a pressão de vapor sofre uma diminuição devido à adição de um soluto não volátil ao líquido (solvente). Esse fenômeno é conhecido como tonoscopia ou tonometria e foi estado por François Marie Raoult (1930-1901), que concluiu o seguinte:
|
A pressão máxima de vapor de uma solução (ΔP) será igual ao produto da fração molar do soluto (X1) com a pressão máxima de vapor do solvente puro (P2). |
A Lei de Raoult é expressa matematicamente pela fórmula:
ΔP = X1 . P2
Em que:
- ΔP é a pressão máxima de vapor da solução.
- X1 é a fração molar do soluto.
- P2 é a pressão máxima de vapor do solvente puro.
Veja também: Gás e vapor são a mesma coisa?
Líquidos voláteis
Existem vários líquidos voláteis que são utilizados nas mais variadas aplicações. Alguns desses líquidos são apresentados a seguir.
- Acetona (propanona): líquido incolor, altamente inflamável, miscível com água e solventes orgânicos. Saiba mais sobre a acetona clicando aqui.
- Clorofórmio (triclorometano): líquido incolor, com odor doce característico, utilizado como solvente em laboratórios e na síntese química.
- Etanol (álcool etílico): líquido incolor, inflamável, utilizado como combustível, solvente e em bebidas alcoólicas.
- Gasolina (mistura de hidrocarbonetos): líquido volátil e inflamável, utilizado como combustível automotivo.
- Água (H₂O): líquido essencial para a vida, solvente universal, moderadamente volátil.
- Querosene: líquido incolor a amarelado, inflamável, utilizado como combustível para aviação e aquecimento.
- Amônia (solução a 32%): solução volátil com odor pungente, utilizada em fertilizantes e como refrigerante industrial.
- Ácido nítrico (63%): líquido incolor a amarelado, altamente corrosivo e volátil, utilizado em sínteses químicas e fabricação de explosivos.
- Metanol (álcool metílico): líquido incolor, inflamável, usado como solvente, combustível e matéria-prima na indústria química.
- Éter dietílico (dietoxietano): líquido incolor, extremamente inflamável e volátil, com odor característico, usado como anestésico no passado e como solvente atualmente.
- Benzeno: líquido incolor, altamente inflamável, usado na síntese de compostos químicos.
- Tolueno (metilbenzeno): líquido volátil com odor doce, utilizado como solvente e na produção de polímeros.
- Diclorometano (cloreto de metileno): líquido incolor, volátil e não inflamável, usado como solvente em laboratórios e na indústria.
- Tetraidrofurano (THF): líquido volátil, usado como solvente em sínteses orgânicas.
- Tricloroetileno: líquido incolor, volátil, usado como solvente e em limpeza industrial.
- Hexano: líquido incolor, inflamável, utilizado como solvente em extrações e na indústria.
- Ácido acético (solvente e ingrediente de vinagre): líquido volátil com odor pungente, usado como solvente e reagente químico.
Líquidos não voláteis
Existem líquidos que são considerados não voláteis. Esses líquidos têm uma baixa pressão de vapor em temperatura ambiente, o que significa que eles evaporam muito lentamente. Abaixo estão alguns líquidos não voláteis:
- Glicerina (propano-1,2,3-triol): usada como umectante em cosméticos (cremes e loções). Em alimentos, atua como aditivo para manter a umidade. É utilizada como solvente em medicamentos e xarope para tosse.
- Óleo mineral: utilizado em lubrificantes industriais e automotivos. Também é empregado como base em óleos para bebês e em cosméticos, além de ser usado em equipamentos médicos para lubrificar componentes.
- Ácido sulfúrico (H₂SO₄): fabricado em grande escala para produção de fertilizantes, é utilizado na indústria química para sínteses e como catalisador. Também é empregado na fabricação de baterias de automóveis.
- Silicones (polidimetilsiloxano): usados como óleos de alta resistência térmica e elétrica em indústrias. Também são aplicados em cosméticos como agentes hidratantes e antiespumantes. Além disso, são utilizados em próteses médicas e lubrificantes não voláteis.
- Mel: utilizado na indústria alimentícia como adoçante natural. Também é empregado em produtos farmacêuticos e cosméticos por suas propriedades hidratantes. Atua como um conservante natural em alguns alimentos.
- Óleo vegetal (exemplo: óleo de soja ou óleo de coco): amplamente utilizado na cozinha para frituras e receitas culinárias. Também é empregado na fabricação de biocombustíveis (biodiesel). Além disso, é usado em cosméticos, como hidratantes e óleos de massagem.
- Etilenoglicol (1,2-etanodiol): utilizado como fluido anticongelante em sistemas de refrigeração de motores. Também é aplicado na indústria química como solvente em reações e sínteses e na fabricação de poliésteres e resinas.
- Ácido fosfórico (H₃PO₄): utilizado na fabricação de fertilizantes fosfatados. Também é empregado como acidulante em bebidas carbonatadas, como refrigerantes. Além disso, é aplicado no tratamento de metais para evitar a corrosão.
- Óleo lubrificante: usado como lubrificante em motores e máquinas industriais. Também é aplicado em sistemas hidráulicos e engrenagens. Além disso, é utilizado como um isolante térmico em transformadores elétricos.
- Mercúrio (elemento metálico líquido): utilizado em termômetros e barômetros (embora em desuso por questões ambientais). Atualmente é empregado na mineração de ouro e prata para formar amálgamas. Além disso, é usado em lâmpadas fluorescentes e dispositivos elétricos específicos. Para saber mais, clique aqui.
- Ácido perclórico (HClO₄): usado na indústria química como agente oxidante. Também é aplicado na produção de sais percloratos, usados em propelentes para foguetes, e, em laboratórios, é utilizado para análises químicas específicas.
Saiba mais: Como ocorre a dilatação térmica dos líquidos?
Volatilidade x pressão de vapor
A volatilidade de uma substância está diretamente relacionada com a sua pressão de vapor, a pressão exercida pelas moléculas de um líquido que escapam para o estado gasoso em equilíbrio dinâmico com o líquido. Observe a imagem abaixo:
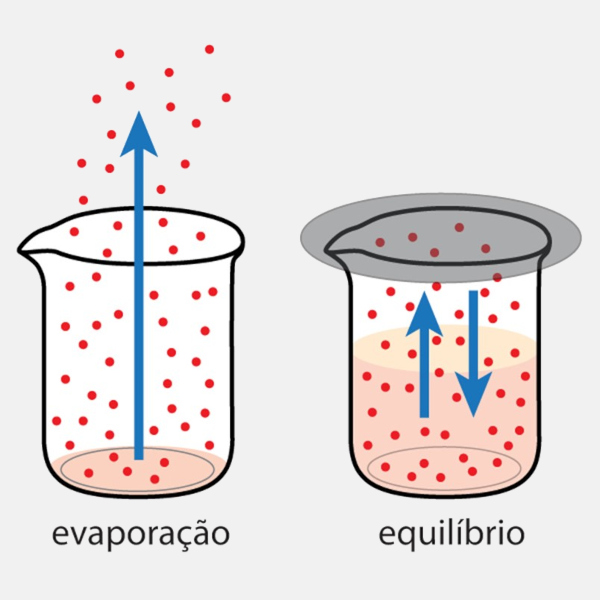
Em recipientes abertos, líquidos tendem a passar completamente para a fase gasosa, já em recipientes fechados, entram em equilíbrio dinâmico. O equilíbrio dinâmico ocorre quando a quantidade de líquido que evapora chega ao seu limite e a fase líquida passa a coexistir com a fase gasosa, com a pressão sendo máxima. Isso quer dizer que, em recipientes fechados, moléculas evaporam e condensam continuamente. A pressão de vapor depende da temperatura:
- Temperaturas mais altas → maior energia cinética → mais moléculas escapam para o estado gasoso → maior pressão de vapor.
- Temperaturas mais baixas → menor energia cinética → menos moléculas escapam → menor pressão de vapor.
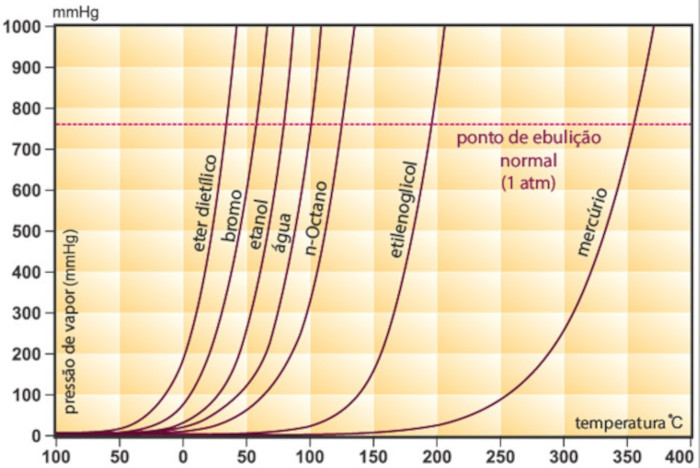
Quando a pressão de vapor se iguala à pressão atmosférica, de 1 atm (760 mmHg), a substância entra em ebulição. Cada substância entra em ebulição em uma temperatura específica, chamada de ponto de ebulição (PE). Isso significa que quanto menor é a pressão de vapor de uma substância, maior é o seu ponto de ebulição, como mostra o gráfico abaixo.
Exercícios resolvidos sobre volatilidade na Química
Questão 1: (UESPI) Quando as manicures estão retirando os esmaltes das unhas das suas clientes, elas usam uma solução removedora à base de acetona. Quando entramos em um hospital sentimos um cheiro característico de éter.
Quando estamos abastecendo o carro com álcool estamos usando um combustível alternativo. A ordem crescente de pressão de vapor para essas três substâncias destacadas no texto será:
Dados: temperatura de ebulição a pressão de 1 atm (acetona = 56,5 °C, éter = 34,6 °C e álcool combustível = 78,5 °C).
a) Éter < álcool < acetona
b) Éter < acetona < álcool
c) Álcool < acetona < éter
d) Álcool < éter < acetona
e) Acetona < éter < álcool
Resposta: c) Álcool < acetona < éter
Resolução: A pressão de vapor de uma substância está inversamente relacionada à sua temperatura de ebulição. Substâncias com pontos de ebulição mais baixos têm maior pressão de vapor, pois suas moléculas escapam mais facilmente para o estado gasoso. Assim, a substância com o menor ponto de ebulição terá a maior pressão de vapor, e a de maior ponto de ebulição terá a menor pressão de vapor.
Análise dos dados:
-
Éter (34,6 °C): Menor ponto de ebulição ⇒ Maior pressão de vapor.
-
Acetona (56,5 °C): Ponto de ebulição intermediário ⇒ Pressão de vapor intermediária.
-
Álcool combustível (78,5 °C): Maior ponto de ebulição ⇒ Menor pressão de vapor.
A ordem crescente de pressão de vapor será: Álcool < acetona < éter. Isso ocorre porque:
- O éter tem o maior valor de pressão de vapor por ter interações intermoleculares mais fracas (forças de dispersão de London).
- O álcool combustível, devido à presença de ligações de hidrogênio, apresenta forças intermoleculares mais fortes, resultando na menor pressão de vapor.
- A acetona, que tem dipolos permanentes, encontra-se em uma posição intermediária.
Questão 2: (Uncisal) O gráfico abaixo representa as variações das pressões de vapor da água e de três amostras líquidas em função da temperatura.
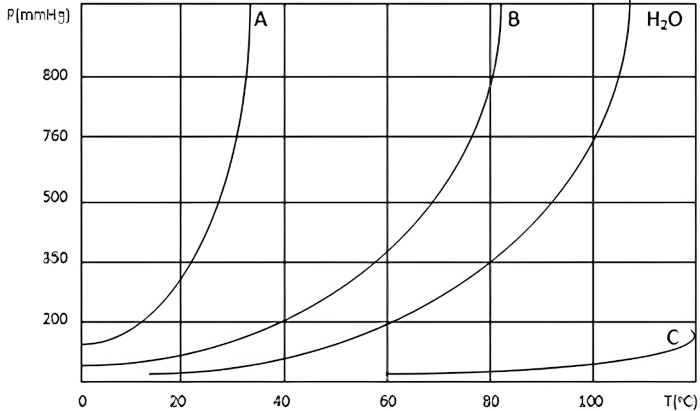
Dadas as assertivas seguintes,
I. A pressão de vapor do líquido A em qualquer temperatura é maior que a do líquido B.
II. O líquido A é menos volátil que o líquido B.
III. O líquido C tem temperatura de ebulição maior que a água.
IV. A pressão de vapor da água em qualquer temperatura é maior que a do líquido A.
V. O líquido C tem a menor pressão de vapor entre todos os líquidos.
Verifica-se que estão corretas apenas:
A) I e IV.
B) I, II e V.
C) III, IV e V.
D) II, III e IV.
E) I, III e V.
Resposta: E) I, III e V.
Resolução:
-
O gráfico permite correlacionar diretamente pressão de vapor com volatilidade e ponto de ebulição.
-
Líquidos com menor pressão de vapor (como o C) têm maior ponto de ebulição e menor volatilidade.
Análise das assertivas:
I. A pressão de vapor do líquido A em qualquer temperatura é maior que a do líquido B.
Correto. O gráfico mostra que a curva de pressão de vapor do líquido A está sempre acima da curva do líquido B, indicando que o líquido A tem maior pressão de vapor em qualquer temperatura.
II. O líquido A é menos volátil que o líquido B.
Falso. A volatilidade está relacionada à facilidade de um líquido evaporar, o que depende da pressão de vapor. Como o líquido A tem maior pressão de vapor que o B, ele é mais volátil.
III. O líquido C tem temperatura de ebulição maior que a água.
Correto. A temperatura de ebulição ocorre quando a pressão de vapor do líquido iguala a pressão atmosférica (760 mmHg). Observa-se que a curva do líquido C cruza a linha de 760 mmHg em uma temperatura superior à da água.
IV. A pressão de vapor da água em qualquer temperatura é maior que a do líquido A.
Falso. No gráfico, a curva da água está acima da curva do líquido A em todas as temperaturas, indicando que a pressão de vapor da água é maior que a do líquido A.
V. O líquido C tem a menor pressão de vapor entre todos os líquidos.
Correto. A curva do líquido C está abaixo de todas as outras curvas, indicando que ele tem a menor pressão de vapor em qualquer temperatura.
Por isso, o gabarito correto é a letra E.
Fontes
ATKINS, P.; JONES, L.; Princípios de Química: questionando a vida moderna e o meio ambiente; 3ª ed.;Porto Alegre; Bookman; 2006.
CHANG, R.; Química Geral: Conceitos Essenciais; 4ªed.; São Paulo;McGraw-Hill;2007.
ATKINS, P. W. PAULA, J. de. Fundamentos de Físico-Química. Vol 1. 5 ed. Rio de Janeiro: LTC, 2003.
SILVA, V. D. Problema no ensino do equilíbrio de fases condensadas com fase de vapor. Quím. nova esc., V. 42, 4, p. 368-372, 2020.


