Classificação e basicidade das aminas
As aminas são compostos orgânicos derivados da substituição de um ou mais átomos de hidrogênio do grupo amônia (NH3) por grupos orgânicos (simbolizados genericamente por “R”). As aminas podem ser classificadas em primárias, secundárias e terciárias, de acordo com a quantidade de grupos orgânicos ligados ao nitrogênio:
Exemplos:
Amina primária: Amina secundária: Amina Terciária:
H CH3 CH3
? ? ?
H ? N ? CH3 H ? N ? CH3 H3C ? N ? CH3
metilamina dimetilamina trimetilamina
Assim como na amônia, nesses três casos o átomo de nitrogênio possui hibridização sp3, com um par isolado de elétrons (o nitrogênio possui 5 elétrons em sua camada de valência e realiza 3 ligações para se manter estável), suas três ligações são sigma (σ).
Existem também íons de amônio quaternários (R4N+), onde até três grupos “R” ligados ao nitrogênio podem ser substituídos por átomos de hidrogênio. Dois exemplos de íons de amônio quaternários são:
Íon tetrametilamônio: (CH3)4N+;
Íon trimetilamônio: (CH3)3N+.
Assim como a amônia, as aminas possuem caráter básico, enquanto os íons de amônio quaternário com pelo menos um átomo de hidrogênio ligado ao nitrogênio são geralmente ácidos.
Esse caráter básico das aminas pode ser explicado pela Teoria Ácido-Base desenvolvida por Gilbert Newton Lewis (1875-1946). As teorias ácido-base de Arrhenius e a de Brönsted e Lowry possuíam limitações, sendo que a primeira só se dava na presença de água e a segunda dependia da presença do hidrogênio. Por isso, Lewis estabeleceu, em 1923, a sua teoria que tinha um significado muito mais amplo, pois abrangia qualquer espécie química. Essa teoria diz o seguinte:

Assim, visto que a amônia e as aminas possuem um par de elétrons isolado, elas atuam como uma base, pois podem doar esses elétrons para algum ácido de Lewis e estabelecer uma ligação covalente, conforme mostrado na reação abaixo:
H F H F
? ? ? ?
H ? N: + B ? F → H ? N : B ? F
? ? ? ?
H F H F
amônia trifluoreto de boro composto neutro
base de Lewis ácido de Lewis formado pelo
fornece o par recebe o par compartilhamento
de elétrons de elétrons de elétrons
Pela teoria ácido-base de Brönsted e Lowry, a amônia e as aminas também eram consideradas bases, pois eram receptoras de prótons H+. No exemplo a seguir, a amônia reage com o ácido clorídrico, recebendo um próton (H+) e formando o íon amônio e o íon cloreto:
NH3 + HC? → NH4+ + C?-
base ácido ácido base
forte forte fraco fraca
As aminas possuem caráter mais básico que os compostos oxigenados, porque o nitrogênio é menos eletronegativo que o oxigênio e, dessa forma, ele é capaz de compartilhar o seu par de elétrons com maior facilidade que o oxigênio. O oxigênio possui dois pares de elétrons isolados e o nitrogênio possui apenas um, sendo que os compostos oxigenados podem ou não ser bases de Lewis.
Entre as aminas, o grau de basicidade é decrescente no seguinte sentido:
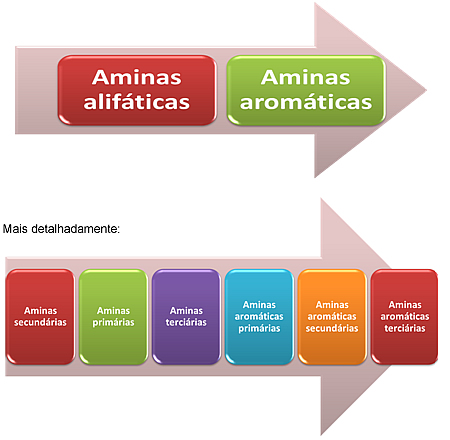
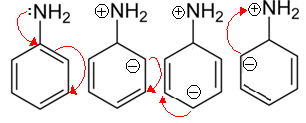
As aminas alifáticas são mais básicas que as aromáticas porque estas últimas podem realizar ressonância com os elétrons das ligações pi do anel benzênico, fazendo com que a sua disponibilidade para a realização de ligações covalentes diminua.
Entre as aminas alifáticas, as secundárias são as mais básicas, seguidas pelas aminas primárias. As terciárias são as que possuem menor caráter básico. Todas as aminas alifáticas são mais básicas que a amônia, que, por sua vez, é mais básica que as aminas aromáticas.