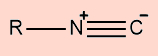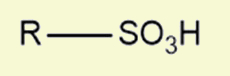Funções orgânicas
As funções orgânicas são subdivisões específicas que existem para os compostos orgânicos. Os compostos orgânicos, os quais são conhecidos por serem feitos de carbono, podem possuir outros átomos em sua estrutura, o que traz diferenças químicas e físicas. Dessa forma, é comum dividir tais compostos em funções específicas, como hidrocarbonetos, funções oxigenadas, funções nitrogenadas e funções sulfuradas, por exemplo.
As funções orgânicas são identificadas por átomos ou grupos atômicos específicos na constituição da molécula, recebendo uma estrutura específica de nomenclatura estabelecida pela Iupac. As funções orgânicas são muito importantes para nosso cotidiano, permeando as linhas de produção e consumo de diversos setores de interesse.
Leia também: Como ocorrem as reações químicas
Resumo sobre funções orgânicas
- Funções orgânicas são divisões dos compostos orgânicos que têm um grupo atômico característico.
- As funções orgânicas são identificadas por um átomo ou grupo atômico padrão, conhecido como grupo funcional.
- Podem ser divididas, basicamente, em hidrocarbonetos, funções oxigenadas, funções nitrogenadas e funções sulfuradas.
- As funções orgânicas possuem nomenclaturas específicas, as quais são estabelecidas pela Iupac.
- Estão presentes nos mais diversos setores da sociedade, como de energia, cosméticos, biotecnologia, polímeros, farmácia, entre muitos outros.
Videoaula sobre funções orgânicas
O que são funções orgânicas?
As funções orgânicas são classes de compostos orgânicos que possuem, em comum, um grupo funcional. Como consequência, os compostos de uma mesma função acabam tendo semelhanças químicas e físicas. A Química Orgânica é a parte da Química que estuda os compostos de carbono. Entretanto, nem só de carbono são feitos esses compostos; outros átomos acabam participando também da constituição, como hidrogênio, oxigênio, nitrogênio, enxofre entre outros.
Dada a grande variação de compostos possíveis que isso pode formar, os compostos são divididos em funções orgânicas, que têm um grupo atômico característico, conhecido como grupo funcional.
Quais são as funções orgânicas?
De fato, existem muitas funções orgânicas, mas as principais serão listadas da seguir.
- Hidrocarbonetos — os quais podem ser divididos em:
a) Alcanos
b) Alcenos
c) Alcinos
d) Cicloalcanos
e) Cicloalcenos
f) Aromáticos
- Funções oxigenadas — nas quais estão presentes:
a) Álcoois
b) Éteres
c) Fenóis
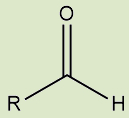
d) Aldeídos
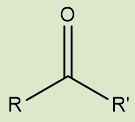
e) Cetonas
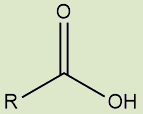
f) Ácidos carboxílicos
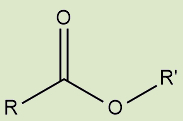
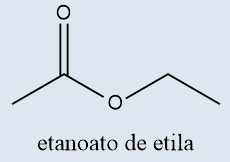
g) Ésteres
- Funções nitrogenadas — nas quais estão presentes:
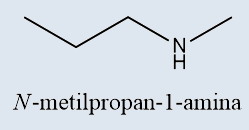
a) Aminas
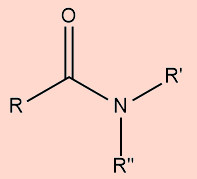
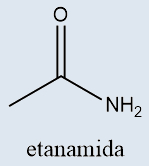
b) Amidas
c) Nitrocompostos
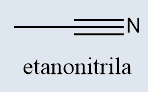
d) Nitrilas
e) Isonitrilas
- Funções halogenadas — nas quais estão presentes:
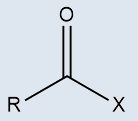
a) Haletos de alquila
b) Haletos de acila (ou haletos ácidos)
- Funções sulfuradas (ou tiocompostos) — nas quais estão presentes:
a) Ácidos sulfônicos
b) Tióis
c) Tioéteres
Veja também: O que são os compostos de Grignard?
Como identificar as funções orgânicas?
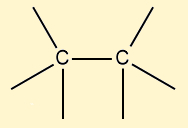
Os compostos orgânicos são identificados por um grupo funcional, que, na verdade, é um grupo de átomos que sempre estará presente em compostos dessa função, atuando como uma espécie de identidade química. Das funções orgânicas, a única que não possui um grupo funcional de fato são os hidrocarbonetos, mas porque esses compostos são também os mais simples: são formados apenas por carbono e hidrogênio.
|
Hidrocarbonetos |
Possuem cadeia aberta e apenas ligações simples entre carbonos |
|
|
|
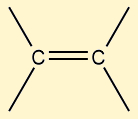
Possuem cadeia aberta e uma ligação dupla entre carbonos |
|
||
|
Alcinos |
Possuem cadeia aberta e uma ligação tripla entre carbonos |
|
|
|
Cicloalcanos |
Possuem cadeia fechada e apenas ligações simples entre carbonos |
|
|
|
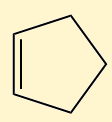
Cicloalcenos |
Possuem cadeia fechada e uma ligação dupla entre carbonos |
|
|
|
Possuem cadeia fechada, todos os carbonos são sp2 e número ímpar de elétrons pi. Obedecem à regra de Hückel |
 |
||
|
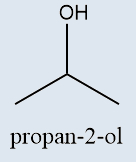
Funções oxigenadas |
Possuem o radical hidroxila diretamente ligado a um carbono sp3 |
|
|
|
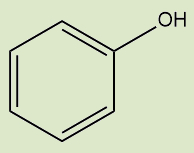
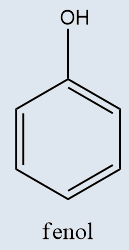
Fenóis |
Possuem o radical hidroxila diretamente ligado a um anel aromático |
|
|
|
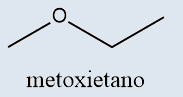
Éteres |
Possuem o átomo de oxigênio entre dois átomos de carbono |
|
|
|
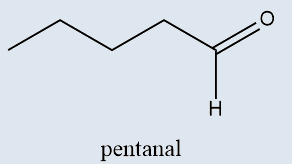
Aldeídos |
Possuem o grupo carbonila na extremidade da cadeia |
|
|
|
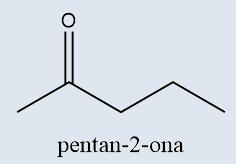
Cetonas |
Possuem o grupo carbonila entre dois átomos de carbono |
|
|
|
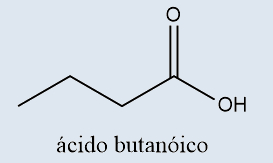
Possuem o grupo carboxila (uma carbonila com uma hidroxila) na extremidade da cadeia |
|
||
|
Ésteres |
Derivados de ácidos carboxílicos, em que o hidrogênio da carboxila é substituído por uma cadeia |
|
|
|
Funções nitrogenadas |
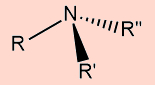
Aminas |
Derivados da amônia, em que os hidrogênios são substituídos por cadeias carbônicas |
|
|
Possuem um átomo de nitrogênio diretamente ligado à carbonila |
|
||
|
Nitrocompostos |
Possuem a presença do grupo nitro |
|
|
|
Nitrilas |
Possuem a presença de um átomo de nitrogênio que realiza uma ligação tripla com o carbono |
|
|
|
Isonitrilas |
Também apresentam o nitrogênio ligado triplamente ao carbono, mas, nesse caso, é o nitrogênio que se liga ao resto da cadeia |
|
|
|
Funções halogenadas |
Haletos de alquila |
Possuem um halogênio (X) diretamente ligado a uma cadeia carbônica |
|
|
Haletos de acila |
Possuem um halogênio (X) diretamente ligado a uma carbonila |
|
|
|
Funções sulfuradas (tiocompostos) |
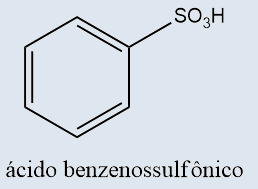
Ácidos sulfônicos |
Possuem a presença do grupo sulfônico na extremidade da cadeia |
|
|
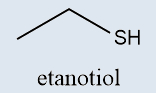
Tióis |
Análogos sulfurados dos álcoois, possuindo o grupo –SH ligado a carbono sp3 |
|
|
|
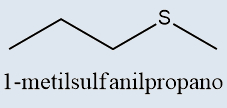
Tioéteres |
Análogos sulfurados dos ésteres, possuindo um átomo de enxofre entre dois átomos de carbono |
|
Nomenclatura das funções orgânicas
Todos os compostos orgânicos seguem regras específicas de nomenclatura, as quais são organizadas pela União Internacional de Química Pura e Aplicada (Iupac, do inglês International Union of Pure and Applied Chemistry). Tais regras estão dispostas em um livro, Nomenclature of Organic Chemistry: Iupac Recommendations and Preferred Names, também conhecido como o Livro Azul (Blue Book), cuja última edição data de 2013.
Basicamente um nome orgânico apresenta três partes:
a) Prefixo: indica o número de carbonos na cadeia.
|
Prefixo |
Número de carbonos |
|
MET- |
1 |
|
ET- |
2 |
|
PROP- |
3 |
|
BUT- |
4 |
|
PENT- |
5 |
|
HEX- |
6 |
|
HEPT- |
7 |
|
OCT- |
8 |
|
NON- |
9 |
|
DEC- |
10 |
b) Infixo: indica se a cadeia apenas possui ligações simples entre carbonos ou se há a presença de ligações duplas e triplas.
|
Infixo |
Ligação |
|
-AN- |
Simples |
|
-EN- |
Dupla |
|
-IN- |
Tripla |
c) Sufixo: indica a função orgânica à qual pertence a cadeia.
Segundo a Iupac, os sufixos correspondentes para as funções orgânicas são:
|
Função |
Sufixo |
Exemplo |
|
Hidrocarbonetos |
-O |
|
|
Álcoois |
-OL |
|
|
Fenol |
-OL |
|
|
Éter |
-ÓXI |
|
|
Aldeído |
-AL |
|
|
Cetona |
-ONA |
|
|
Ácido carboxílico |
-OICO |
|
|
Éster |
-OATO / -ILA |
|
|
Amina |
-AMINA |
|
|
Amida |
-AMIDA |
|
|
Nitrila |
-NITRILA |
|
|
Tiol |
-TIOL |
|
|
Tioéter |
-SULFANIL |
|
|
Ácido sulfônico |
-SULFÔNICO |
|
Nem todas as funções orgânicas possuem um sufixo específico, como é o caso das funções halogenadas. Nesse caso, os halogênios são alocados como prefixos para caracterização do grupo (como em 2-fluorbutano ou cloreto de etanoíla). O mesmo ocorre para algumas funções nitrogenadas, como é o caso dos nitrocompostos e das isonitrilas, que utilizam o prefixo “nitro” e “isociano” para identificação, respectivamente, em vez de um sufixo específico (como em nitrobenzeno e em 1-isocianobutano).
Tanto o ácido carboxílico quanto o ácido sulfônico devem iniciar seu nome oficial com a palavra “ácido”. Os fenóis recebem o sufixo “-ol”, com exceção do caso em que a hidroxila está ligada ao benzeno, pois, nesse caso, o nome do composto é fenol (e não benzenol).
Propriedades das funções orgânicas
As propriedades das funções orgânicas estão intimamente ligadas à sua estrutura. O carbono e o hidrogênio possuem uma diferença de eletronegatividade muito pequena, o que permite dizer que os hidrocarbonetos são muito pouco polares, sendo até mesmo considerados apolares. Com essa polaridade muito baixa, as moléculas de hidrocarbonetos interagem entre si por meio de interações dipolo induzido-dipolo induzido, também conhecidas como forças de dispersão de London.
Para que uma molécula mude de fase, por exemplo, em uma ebulição, essas forças intermoleculares devem ser rompidas, permitindo o afastamento das moléculas. Sendo as interações dipolo induzido-dipolo induzido bem fracas, vê-se que os hidrocarbonetos de baixo volume molecular são gases (a área para interação intermolecular é baixa).
Contudo, tais forças intermoleculares são somativas, o que quer dizer que, conforme as moléculas vão aumentando, a intensidade das interações também vai aumentando. Por isso, percebe-se que as temperaturas de mudança de fase (como fusão e ebulição) dos hidrocarbonetos aumenta com o tamanho da cadeia.
|
Alcano |
Temperatura de ebulição (°C) |
|
Metano |
−162 |
|
Etano |
−89 |
|
Propano |
−42 |
|
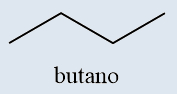
Butano |
−1 |
|
Hexano |
69 |
|
Heptano |
98 |
|
Octano |
126 |
As demais funções podem mudar essa condição de baixa polaridade pela introdução de átomos mais eletronegativos, que criam uma polarização na molécula. Por isso, as demais funções, como oxigenadas, nitrogenadas, halogenadas e sulfuradas, podem ter interações do tipo dipolo-dipolo, característica de moléculas polares, as quais são mais intensas. Como consequência, compostos dessas funções apresentam pontos de ebulição maiores que os hidrocarbonetos de tamanho semelhante.
Os álcoois, os fenóis, os ácidos carboxílicos, as aminas e as amidas ainda têm a possibilidade de realizarem ligações de hidrogênio, as quais possuem o mesmo mecanismo das interações dipolo-dipolo, mas são ainda mais intensas dada maior polarização e aproximação. Assim sendo, essas funções podem apresentar maiores temperaturas de mudança de fase.
|
Temperaturas de ebulição (°C) e interação mais forte realizada |
|||
|
Alcanos |
Éteres |
Álcoois |
Aminas |
|
Propano, C3H8 −42 |
Metóxi-metano, C2H6O −24 |
Etanol, C2H6O 78 |
Etanamina, C2H7N 17 |
|
Butano, C4H10 −1 |
Metóxi-etano, C3H8O 11 |
Propan-1-ol, C3H8O 97 |
Propan-1-amina, C3H9N 48 |
|
Dipolo induzido-dipolo induzido |
Dipolo-dipolo |
Ligação de hidrogênio |
Ligação de hidrogênio |
No caso da solubilidade, uma das formas de se perceber se um composto orgânico é solúvel em determinado solvente é por meio da regra do semelhante, que diz que compostos polares só são dissolvidos por solventes polares, assim como compostos apolares só serão dissolvidos por compostos apolares.
Tal regra é consequência das interações soluto-solvente. A água, considerada o solvente universal, é polar, e, assim sendo, moléculas apolares (sem um polo definido) não conseguem atrair as moléculas de água. Além disso, para que a água dissolva os hidrocarbonetos, ela deve abrir mão de suas ligações de hidrogênio e formar interações mais fracas com os hidrocarbonetos, de caráter muito pouco polar, o que não é termodinamicamente favorável para a água. Hidrocarbonetos dissolvem bem em solventes apolares.
Assim sendo, solventes polares, os quais realizam, no mínimo, interações dipolo-dipolo, só conseguirão dissolver, com boa extensão, moléculas de maior caráter polar. Ocorre que, conforme a cadeia orgânica aumenta, os grupos polares se tornam pouco significativos. Como consequência, há um aumento do caráter apolar da molécula e, assim sendo, uma menor solubilidade em solventes polares, como a água.
|
Solubilidades em água |
||
|
Nº de carbonos |
Éteres |
Cloretos de alquila |
|
1 |
- |
CH3Cl – solúvel |
|
2 |
CH3OCH3 – solúvel |
CH3CH2Cl – pouco solúvel |
|
3 |
CH3OCH2CH3 – solúvel |
CH3(CH2)2Cl – pouco solúvel |
|
4 |
CH3CH2OCH2CH3 – pouco solúvel |
CH3(CH2)3Cl – insolúvel |
|
5 |
CH3CH2OCH2CH2CH3 – muito pouco solúvel |
- |
Alguns compostos orgânicos também podem apresentar caráter ácido ou básico significativo. Os ácidos carboxílicos, os ácidos sulfônicos e os fenóis são ácidos orgânicos reconhecidos, podendo apresentar uma certa ionização em água, aumentando a concentração de íons H3O+/H+.
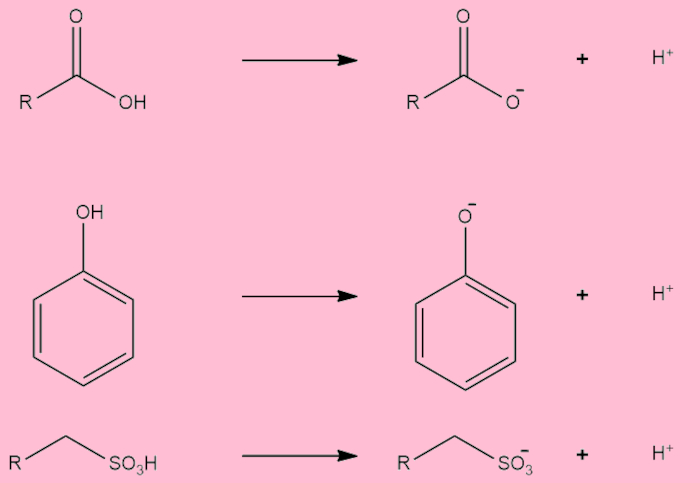
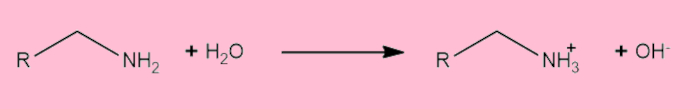
Já as aminas são reconhecidas bases orgânicas, muito por causa do par de elétrons não ligantes presente no nitrogênio, que permite a ele atuar como nucleófilo. No caso, as aminas podem aumentar a concentração dos íons OH− em solução.
Aplicações das funções orgânicas
Os compostos orgânicos possuem aplicações diversas. É até mesmo possível dizer que, todos os dias, usamos produtos que contêm as mais diversas funções orgânicas. Por exemplo, os hidrocarbonetos, reconhecidos como as funções mais simples, estão presentes nos combustíveis fósseis, no asfalto, em diversos solventes de uso doméstico ou industrial, além de serem ponto de partida para a fabricação de uma gama de polímeros sintéticos (plásticos), como o polietileno e o polipropileno.
Polímeros, aliás, também podem ser produzidos por meio de diversas funções, dando origens às diversas classes de polímeros, como policarbonatos, poliésteres, poliuretanos, poliamidas, entre outras.
Os álcoois também são muito importantes, principalmente por causa do etanol, um biocombustível que pode ser extraído da cana de açúcar ou do milho, por exemplo. É o próprio etanol que, ao reagir com gorduras (ésteres de ácidos graxos) é capaz de produzir outro biocombustível importante, que é o biodiesel. O etanol ainda é importante como solvente, sendo aplicado em cosméticos, como o perfume, e para a indústria alimentícia na confecção de bebidas. Outro álcool muito importante é o propan-1-ol (álcool isopropílico), amplamente empregado para limpeza de dispositivos eletrônicos.
As cetonas e os aldeídos são empregados na fabricação de perfumes, pois estão presentes em diversas fragrâncias. O formaldeído (metanal) é amplamente usado como conservante de matéria orgânica, sendo conhecido popularmente como formol. Já a propanona, a cetona mais simples, é muito importante como solvente, como, por exemplo, para os esmaltes de unhas.
As funções orgânicas são empregadas na síntese de fármacos e medicamentos. Quando um fármaco é confeccionado, algumas funções orgânicas são estrategicamente alocadas na molécula para produzirem um efeito específico ou até mesmo serem metabolizadas no ambiente químico correto.
De certa forma, é difícil pensar um setor comercial ou industrial que não utilize produtos com as mais diversas funções orgânicas. A seguir, citamos alguns exemplos de aplicação das funções orgânicas na sociedade:
- Indústria têxtil: fibras naturais e sintéticas.
- Indústria alimentícia: bebidas alcoólicas, conservantes e aditivos alimentares.
- Agroindústria: pesticidas e outros defensivos agrícolas.
- Indústria de petróleo: combustíveis fósseis, resinas, lubrificantes, óleos, entre outros.
- Indústria farmacêutica: produção de medicamentos para diversas formas de administração.
- Produtos de limpeza: desinfetantes, sabões, tensoativos.
- Polímeros sintéticos e plásticos.
- Biocombustíveis: etanol de primeira e segunda geração, biodiesel, diesel verde, entre outros.
- Solventes para usos no cotidiano e para uso industrial.
- Indústria de cosméticos: perfumaria, hidratantes, cremes, maquiagens, entre outros.
Saiba mais: Quais são as funções inorgânicas?
Exercícios resolvidos sobre funções orgânicas
Questão 1. (Uerj/2022) Observe a fórmula estrutural plana da DEET, substância empregada como repelente de insetos:
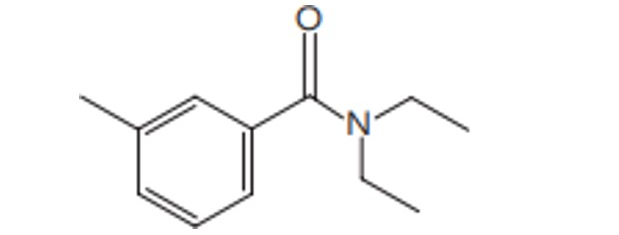
Com base na análise dessa estrutura química, verifica-se que a DEET pertence à seguinte função orgânica:
(A) éter
(B) amina
(C) amida
(D) cetona
Resposta: Letra C.
Percebe-se um átomo de nitrogênio diretamente ligado a uma carbonila, o que configura uma amida.
Questão 2. (Enem Libras/2017) Plantas apresentam substâncias utilizadas para diversos fins. A morfina, por exemplo, extraída da flor da papoula, é utilizada como medicamento para aliviar dores intensas. Já a coniina é um dos componentes da cicuta, considerada uma planta venenosa. Suas estruturas moleculares são apresentadas na figura.

O grupo funcional comum a esses fitoquímicos é o(a)
(A) éter.
(B) éster.
(C) fenol.
(D) álcool.
(E) amina.
Resposta: Letra E.
É possível perceber que, nas duas estruturas, há em comum um átomo de nitrogênio, o que configura uma função nitrogenada. Esse nitrogênio não se liga a uma carbonila e, portanto, classifica-se tal função como uma amina.
Fontes
FAVRE, H. A.; POWELL, W. H.; MOSS, G. P. Nomenclature of Organic Chemistry. Iupac Recommendations and Preferred Names 2013. Londres: Royal Society of Chemistry, 2013.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.