Funções nitrogenadas
Funções nitrogenadas são as funções orgânicas que têm a presença do átomo de nitrogênio em sua constituição. Dada a quantidade de ligações covalentes possíveis para o nitrogênio, tais compostos são variados, podendo formar cadeias homogêneas ou heterogêneas. Dentre as principais funções nitrogenadas, é possível citar as aminas, as amidas, os nitrocompostos, as iminas e as nitrilas.
Funções nitrogenadas têm seus nomes oficiais estabelecidos pela União Internacional de Química Pura e Aplicada (Iupac), assim como os demais compostos orgânicos. Destacam-se pela maior solubilidade e pelos maiores pontos de fusão e ebulição, em comparação aos hidrocarbonetos, e pelo caráter básico das aminas. São usadas na fabricação de medicamentos, agricultura, corantes e em diversos polímeros.
Leia também: O que são hidrocarbonetos?
Resumo sobre funções nitrogenadas
- Funções nitrogenadas são as funções orgânicas que têm átomos de nitrogênio na constituição da cadeia carbônica.
- Entre as principais funções nitrogenadas, estão as aminas, amidas, iminas, os nitrocompostos e as nitrilas.
- Em geral, os compostos nitrogenados têm maior ponto de fusão e ebulição que os hidrocarbonetos respectivos, dado maior caráter polar.
- Os compostos nitrogenados também têm maior solubilidade em água que os hidrocarbonetos, não só por conta do maior caráter polar como também pela possibilidade de ligação de hidrogênio.
- Os compostos nitrogenados são aplicados em diversos campos, como na fabricação de medicamentos, na agricultura, na fabricação de corantes e de polímeros sintéticos.
Videoaula sobre funções nitrogenadas
O que são funções nitrogenadas?
As funções nitrogenadas são funções orgânicas com a presença de átomos de nitrogênio. O nitrogênio também é um elemento presente em compostos orgânicos. Sendo assim, caso a cadeia carbônica tenha a presença desse elemento, podemos dizer que se trata de uma função nitrogenada.
O nitrogênio, como um elemento do grupo 15, tem cinco elétrons de valência e, assim, realiza três ligações covalentes com os demais átomos da cadeia carbônica. Por conta disso, é possível que existam compostos nitrogenados homogêneos ou heterogêneos.
Quais são as principais funções nitrogenadas?
Embora existam diversos compostos orgânicos nitrogenados, é possível listar aqui os principais:
- aminas;
- amidas;
- nitrocompostos;
- iminas;
- nitrilas.
Veja também: O que é e para que serve a nitroglicerina?
Como identificar as funções nitrogenadas?
As funções nitrogenadas, como todos os compostos orgânicos, são identificadas pelo seu grupo funcional.
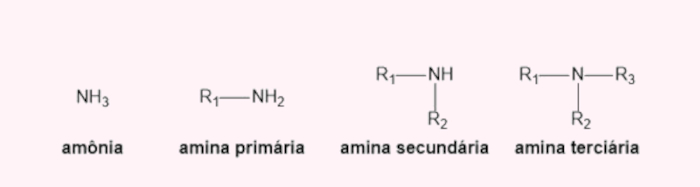
- Aminas: são derivados orgânicos da amônia (NH3). Assim sendo, um composto é identificado como uma amina quando um ou mais hidrogênios da amônia é substituído por um grupo alquila. Como a amônia tem três nitrogênios, existem as aminas primárias (homogêneas), secundárias e terciárias (heterogêneas). Saiba mais sobre as aminas clicando aqui.
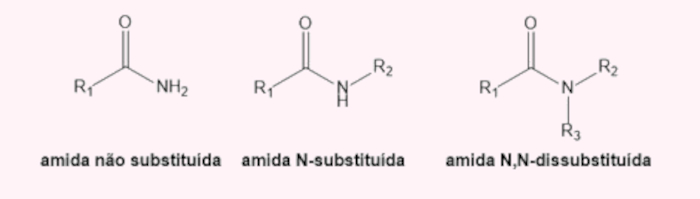
- Amidas: são compostos orgânicos em que um átomo de nitrogênio é diretamente ligado à carbonila. Por conta disso, alguns autores também costumam dizer que as amidas são derivadas dos ácidos carboxílicos, em que, no lugar da hidroxila, há o nitrogênio. Para saber mais sobre as amidas, clique aqui.
- Nitrocompostos: são compostos que podem ser identificados quando o grupo nitro (−NO2) está ligado a uma cadeia carbônica. Para saber mais sobre nitrocompostos, clique aqui.
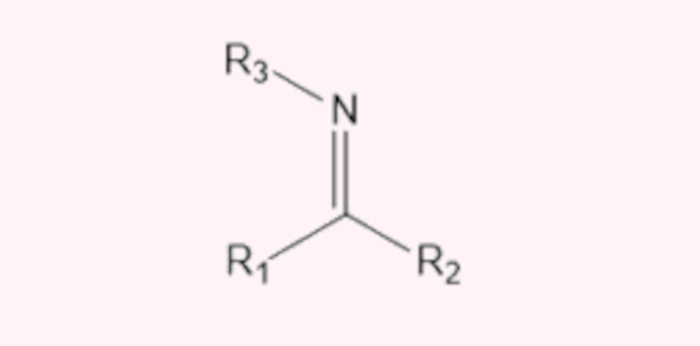
- Iminas: são compostos nitrogenados análogos aos aldeídos ou cetonas, ou seja, apresentam uma ligação dupla entre carbono e nitrogênio.
- Nitrilas: são compostos nitrogenados que têm uma ligação tripla entre carbono e nitrogênio (RC≡N), por isso, são derivados orgânicos do ácido cianídrico (HC≡N). Saiba mais sobre as nitrilas clicando aqui.
Nomenclatura das funções nitrogenadas
As nomenclaturas das funções nitrogenadas são determinadas pela União Internacional de Química Pura e Aplicada (Iupac). A seguir, são especificadas as regras para cada uma das funções nitrogenadas já referenciadas.
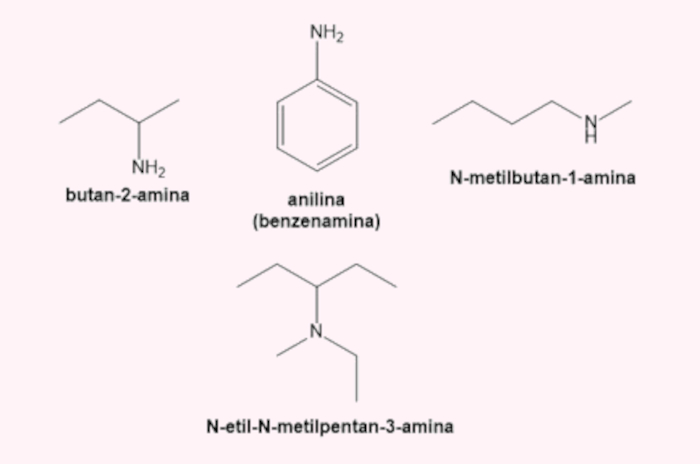
→ Nomenclatura das aminas
Recebem o sufixo -amina. Para as aminas primárias, a benzenamina é mais comumente conhecida como “anilina”, e a própria Iupac reconhece isso. No caso das aminas secundárias e terciárias, as cadeias não principais ligadas ao nitrogênio são indicadas no nome oficial precedidas pela letra N e em ordem alfabética. Quando necessário, sendo amina primária, secundária ou terciária, a posição do nitrogênio deve ser indicada.
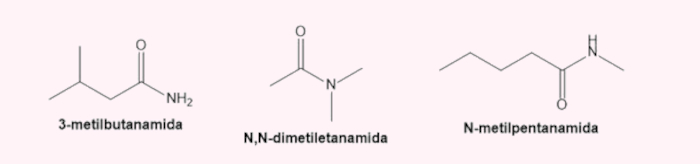
→ Nomenclatura das amidas
Recebem o sufixo -amida. Seguem as mesmas regras das aminas, com as diferenças: o carbono da carbonila é sempre o de número 1, e a cadeia principal é a que contém esse grupo.
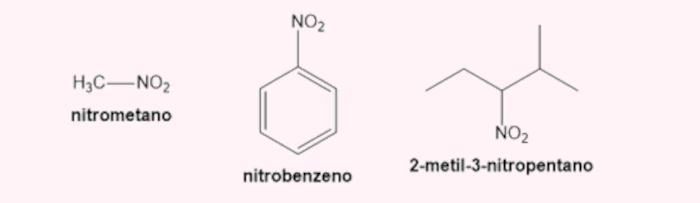
→ Nomenclatura dos nitrocompostos
Segundo a Iupac, deve-se adicionar o prefixo nitro- antes do nome da cadeia principal.
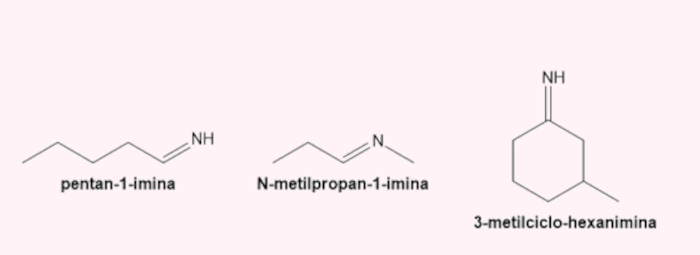
→ Nomenclatura das iminas
Recebem o sufixo -imina. A estrutura da nomenclatura é idêntica à utilizada para as aminas.
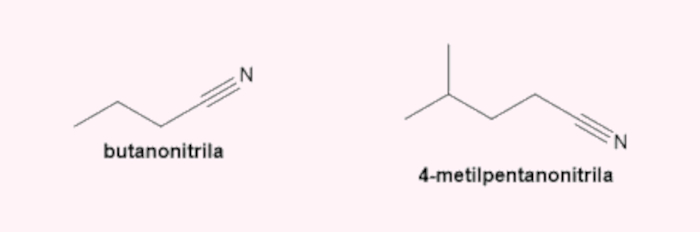
→ Nomenclatura das nitrilas
Recebem o sufixo -nitrila, e o carbono que faz a ligação tripla com o nitrogênio é sempre o de número 1.
Características das funções nitrogenadas
Em termos de propriedades físicas, como solubilidade em água e temperaturas de fusão e ebulição, os compostos nitrogenados seguem, de maneira geral, a tendência dos demais compostos orgânicos. Assim, compostos nitrogenados com maior cadeia carbônica têm maior caráter apolar, pois este se torna mais significativo. Como consequência, tais compostos apresentarão maior hidrofobicidade (menor solubilidade em água).
Da mesma forma, o aumento do volume molecular causado pelo aumento da cadeia carbônica intensifica as interações intermoleculares. Por conta disso, as temperaturas de fusão e ebulição aumentam.
Particularmente falando, o átomo de nitrogênio é mais eletronegativo que o carbono, por isso entende-se que os compostos nitrogenados têm certo caráter polar, o que, de forma geral, explica o fato desses compostos terem maior ponto de fusão e ebulição, além de solubilidade em água, quando comparados aos hidrocarbonetos, os quais são apolares ou muito pouco polares.
Contudo, essa polaridade é menor que os compostos oxigenados, considerando que o átomo de oxigênio é mais eletronegativo que o átomo de nitrogênio.
Além disso, o átomo de nitrogênio é capaz de realizar ligações de hidrogênio, interações intermoleculares mais intensas. Assim, todos os compostos nitrogenados podem realizar, por exemplo, ligações de hidrogênio com a água, o que, em tese, aumenta a solubilidade da substância.
Aqueles que têm átomo de hidrogênio ligado ao nitrogênio podem, ainda, realizar, entre si, ligações de hidrogênio, o que faz aumentar as temperaturas de mudança de fase.
A tabela a seguir traz algumas propriedades físicas de algumas aminas.
|
Amina |
Ponto de fusão (°C) |
Ponto de ebulição (°C) |
Solubilidade em água (g.100 mL−1 H2O) |
|
Etanamina |
−81 |
17 |
Muito solúvel |
|
N-etiletanamina |
−48 |
56 |
Muito solúvel |
|
N,N-dietiletanamina |
−115 |
90 |
14 |
|
Anilina |
−6 |
184 |
3,7 |
|
N-fenilanilina |
53 |
302 |
Insolúvel |
|
N,N-dimetilanilina |
3 |
194 |
Pouco solúvel |
Por apresentar um par de elétrons não ligante, o nitrogênio é também uma base de Lewis. Vale lembrar que, pela teoria de Lewis, uma base é uma espécie doadora de par de elétrons. Assim sendo, deve-se destacar o caráter alcalino das aminas.
Embora não sejam bases tão fortes quando comparadas às principais bases orgânicas, as aminas são mais básicas que a água. Contudo, esse comportamento não se estende para todos os compostos nitrogenados.
R−NH2 + H2O ⇌ R−NH3+ + OH−
A anilina, por exemplo, apesar de ser uma amina, não é básica, visto que é um composto que tem estabilidade por ressonância, diferentemente da sua forma protonada. As amidas, por exemplo, são muito pouco básicas. Tão pouco básicas que o oxigênio é mais facilmente protonado que o próprio nitrogênio.
Saiba mais: Ponto de fusão e ponto de ebulição dos elementos químicos na Tabela Periódica
Aplicações das funções nitrogenadas
As funções nitrogenadas desempenham diversos papéis importantes para a sociedade. A seguir, é possível listar alguns.
- Produção de fármacos e medicamentos: muitas aminas e amidas são precursoras de fármacos, sendo, assim, importantes na fabricação de medicamentos diversos.
- As aminas são utilizadas na fabricação de produtos de limpeza e de higiene pessoal.
- A anilina (benzenamina) é um importante produto para a fabricação de corantes.
- Sendo o nitrogênio um dos macronutrientes das plantas, é comum a utilização de compostos nitrogenados em plantações, como é o caso de aminas para a fabricação de fertilizantes. Além disso, alguns compostos nitrogenados podem ser usados como herbicidas.

- Alguns compostos nitrogenados são usados na fabricação de polímeros sintéticos, como é o caso do náilon, da poliacrilamida e do poliuretano.
- Os nitrocompostos, em sua maioria, são explosivos. Destaca-se o trinitrotolueno, conhecido como TNT.
Exercícios resolvidos sobre funções nitrogenadas
Questão 1. (USS-Univassouras Medicina/2024-1) A nicotina, encontrada no tabaco, é a principal substância responsável pela dependência do fumo. A fórmula estrutural dessa substância é:
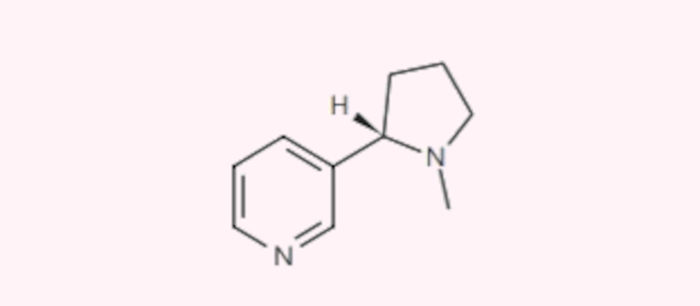
A função orgânica presente na cadeia saturada da nicotina é:
(A) aldeído.
(B) amida.
(C) amina.
(D) éter.
Resposta: Letra C
Trata-se de uma amina, pois percebe-se que o átomo de nitrogênio está ligado a três átomos de carbono. A outra opção de função nitrogenada, amida, só seria possível se os átomos de nitrogênio estivessem ligados a uma carbonila, o que não ocorre.
Questão 2. (Uerj/2022) Observe a fórmula estrutural plana da DEET, substância empregada como repelente de insetos:

Com base na análise dessa estrutura química, verifica-se que a DEET pertence à seguinte função orgânica:
(A) éter
(B) amina
(C) amida
(D) cetona
Resposta: Letra C
Percebe-se que o átomo de nitrogênio está ligado diretamente a uma carbonila, o que caracteriza uma amida.
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
FAVRE, H. A.; POWELL, W. H.; MOSS, G. P. Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013. Londres: Royal Society of Chemistry, 2013.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.


