Ésteres
Éster é uma função orgânica que pode ser identificada pela presença de um grupo R–COO-R’, sendo R o radical orgânico. Os ésteres estão presentes nas ceras produzidas por plantas e animais, para reduzir a perda de água, nas essências das frutas, em produtos alimentícios artificiais e em medicamentos e biocombustível. Podem ser formados por esterificação, em que os reagentes são um ácido carboxílico e um álcool.
Leia também: Sais de ácidos carboxílicos – compostos muito utilizados na fabricação de sabões
Estrutura dos ésteres
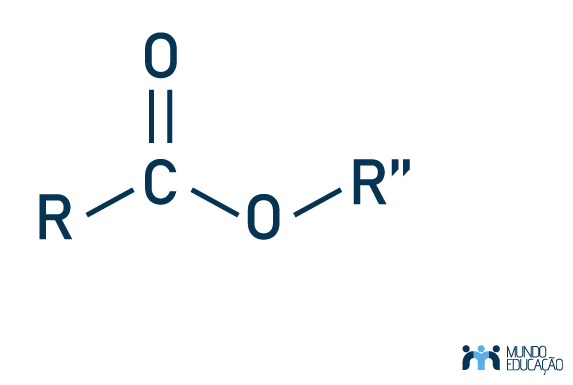
A estrutura de um éster é composta por dois oxigênios ligados a um mesmo carbono, um deles realizando dupla ligação e outro se ligando a um radical orgânico. Veja a imagem a seguir, considerando R como radical orgânico:
Classificação dos ésteres

Os ésteres podem ser classificados de acordo com os aspectos físicos das substâncias a que dão origem. Ésteres provenientes da reação de esterificação, ou seja, formados por um ácido carboxílico e um álcool, são denominados essências de frutas, isso porque eles são as substâncias que dão aroma e sabor às frutas, usados também como aromatizantes artificiais.
Os triglicerídeos, ou triésteres, são os ésteres classificados como lipídios, são lipossolúveis, ou seja, não possuem afinidade com a água. Formado por organismos vivos, o triglicerídeo é produto da junção de ácido graxo e glicerol. Por último, temos as ceras, formadas por ácidos graxos com mais de 10 carbonos (nessa classificação só teremos um grupo -COOH na cadeia). As ceras são produzidas por organismos vegetais e animais e funcionam como um revestimento para desacelerar a perda de água.

Nomenclatura dos ésteres
Para dar nome a um éster, é necessário conheceras regras da União Internacional de Química Pura e Aplicada (Iupac) para compostos orgânicos.
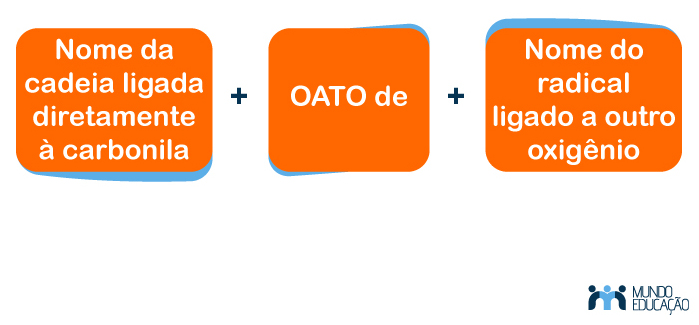
Lembrando que a nomenclatura para compostos orgânicos é dada pelo número de carbonos subsequentes e a saturação da cadeia, sendo que a estrutura desta pode ser ramificada, normal de cadeia aberta ou fechada e que a nomenclatura do radical possui o diferencial da terminação -il ou -ila. A nomenclatura do composto sempre se inicia pelo radical ligado diretamente à carbonila (C=O).
Exemplo 1:
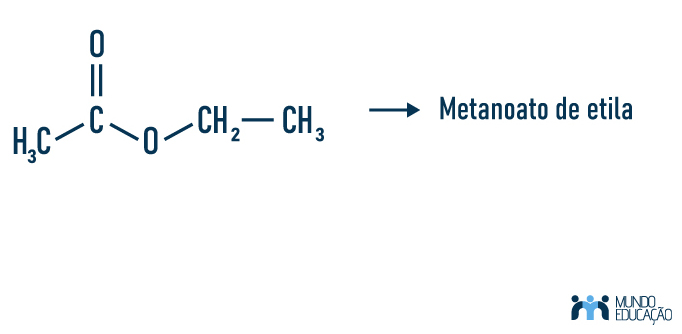
Perceba que, começando a nomenclatura pelo radical ligado à carbonila, teremos
Met-, pois se trata de um único carbono, e no outro radical ligado ao outro oxigênio do composto teremos Et-, referindo-se aos dois carbonos com terminação -ila.
Exemplo 2:
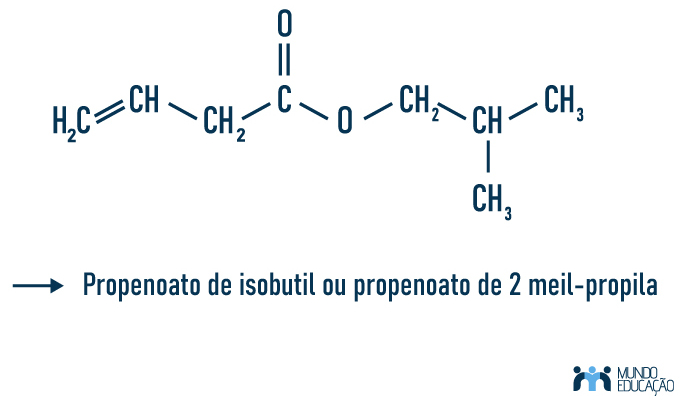
Nesse caso temos que os radicais possuem insaturação e ramificação. Note que se seguem as regras de nomenclatura para hidrocarbonetos. No primeiro radical propen-, temos prop-, referente aos três carbonos, e -en-, designando que há insaturação na cadeia. No segundo radical, temos isobutil ou 2-metilpropila, que fazem menção à mesma estrutura composta por quatro carbonos, sendo um deles uma ramificação.
Para saber mais detalhadamente de que forma é composta a nomenclatura dessa função oxigenada, acesse o texto: Nomenclatura dos ésteres.
Obtenção dos ésteres
Os ésteres são obtidos por meio de reações de substituição. Uma das reações mais importantes de obtenção do éster é a esterificação, que acontece entre um álcool e um ácido carboxílico, em que o hidrogênio da carboxila é substituído pelo radical orgânico proveniente do álcool. Essa reação é catalisada por ácidos fortes, e, apesar de não acontecer com 100% de aproveitamento, os produtos principais são moléculas de água e éster. Veja:
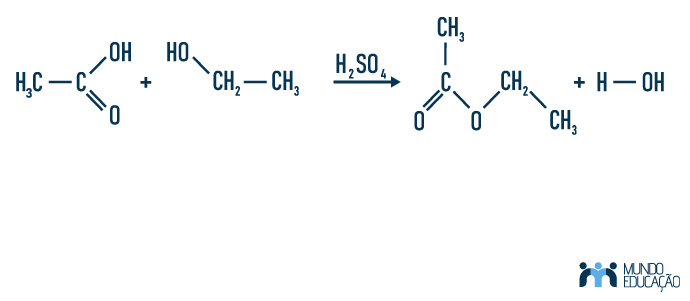
É também possível obter-se um éster reagindo cloretos ácidos com álcool — uma reação perigosa por ser extremamente exotérmica e pelos cloretos ácidos serem substâncias corrosivas e propensas a sofrer hidrólise. Veja:
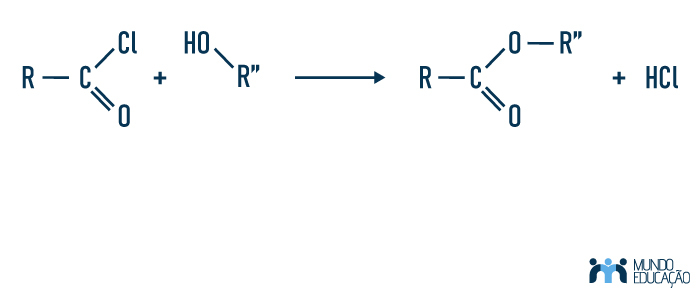
Outra possível forma de obter-se ésteres é por meio da substituição do hidrogênio de uma hidroxila de um álcool ou fenol por um grupo acila (R-C=O) de um anidrido (ácido carboxílico desidratado). É a reação que acontece para a formação de aspirina, fármaco usado para tratamento de dor, febre e inflamações.
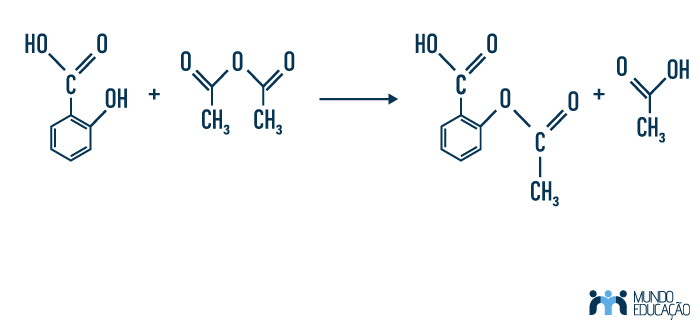
Acesse também: Como se dá a obtenção das aminas?
Aplicação dos ésteres
- Como aromatizantes e essências artificiais, usados em balas, bolachas e outros alimentos industrializados e também no setor de perfumaria e cosméticos.
- Na fabricação de fármacos como a aspirina.
- Na fabricação de biocombustível.
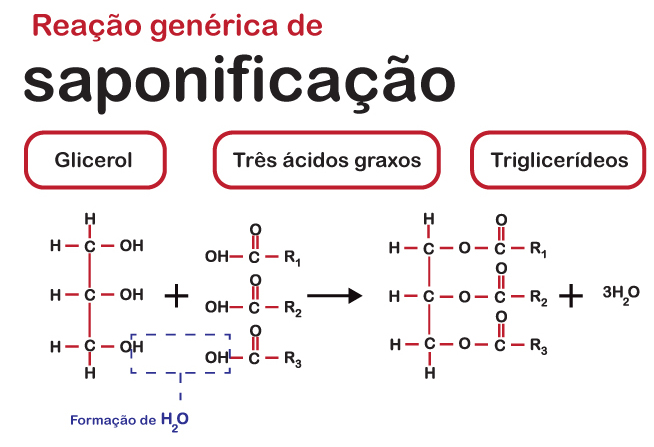
- Na fabricação de produtos de limpeza por reação de saponificação, tendo-se como produto sabão e glicerol.
Exercícios resolvidos
Questão 1 – (Enem) A própolis é um produto natural conhecido por suas propriedades anti-inflamatórias e cicatrizantes. Esse material contém mais de 200 compostos identificados até o momento. Entre eles, alguns são de estrutura simples, como é o caso do C6H5CO2CH2CH3, cuja estrutura está mostrada a seguir.
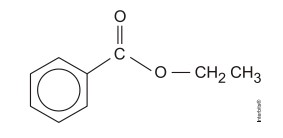
O ácido carboxílico e o álcool capazes de produzir o éster em apreço por meio da reação de esterificação são, respectivamente:
A) ácido benzoico e etanol.
B) ácido propanoico e hexanol.
C) ácido fenilacético e metanol.
D) ácido propiônico e cicloexanol.
E) ácido acético e álcool benzílico.
Resolução
Alternativa A.
Lendo a questão, já temos a informação de que o éster demonstrado é proveniente de um ácido carboxílico e um álcool. Sabendo também que a reação de esterificação acontece formando um éster e uma molécula de água, podemos fazer a adição da hidroxila e do hidrogênio, para assim obtermos as moléculas de origem. Veja:
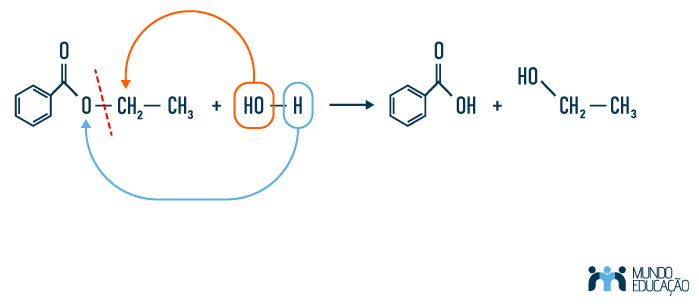
Dessa forma, vemos que as moléculas obtidas são um ácido benzoico e um etanol.
Questão 2 – (UPF) A seguir, está representada a estrutura do éster responsável pelo flavor (sabor) de abacaxi.
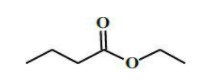
Marque a opção que indica corretamente os reagentes que podem ser usados para produzir esse éster via reação de esterificação catalisada por ácido.
A) CH₃(CH₂)₂COOH + CH₃CH₂OH
B) CH₃CH₂COOH + CH₃CH₂Cl
C) CH₃CH₂CH₂CH₂OH + CH₃COOH
D) CH₃(CH₂)₂COCH₃ + CH₃CH₂CH₂CH₃
E) CH₃(CH₂)₂CHO + CH₃CH₂OH
Resolução
Alternativa A.
Sabendo que a reação de esterificação acontece de um ácido carboxílico e um álcool, devemos procurar uma opção que contenha duas moléculas dessas funções. Já eliminamos aqui a alternativa B, que, apesar de conter um ácido carboxílico, tem como outra molécula um haleto orgânico; a alternativa D, que contém uma cetona e um alcano; e a alternativa E, que contém dois álcoois, restando-nos apenas alternativas A e C. Observando a molécula de éster dada pela questão, podemos ver que o ácido formador possui quatro carbonos, e o álcool, dois, portanto, a letra A é a alternativa que contém os reagentes formadores: ácido butanoico e etanol.
