Condições para a ocorrência de reações químicas

A velocidade com que as reações se processam varia muito, e existem alguns fatores que interferem não só nessa velocidade, mas até mesmo na ocorrência dessas reações. Eles são basicamente quatro: contato entre os reagentes, afinidade química, colisões favoráveis e energia de ativação.
- Contato entre os reagentes: Para que as moléculas dos reagentes possam colidir umas com as outras, é necessário que elas entrem em contato.
Por exemplo, o sódio é um elemento metálico que reage com o oxigênio, oxidando-se em minutos quando em contato com o ar. Reage também violentamente com a água, como mostra a imagem abaixo:

Reação violenta entre sódio e água quebra recipiente de vidro*
Assim, para não entrar em contato com o oxigênio e com a umidade do ar, o sódio metálico é guardado em querosene:

- Afinidade química: Essa propriedade diz respeito à capacidade que uma substância tem de reagir com a outra, pois mesmo se duas ou mais substâncias forem colocadas em contato, mas não houver afinidade entre elas, não ocorrerá a reação.
Não há afinidade química entre o sódio e o querosene, por exemplo, assim como acontece com um giz deixado exposto no ar, eles nunca irão reagir, porque não há afinidade química entre eles, o giz permanecerá intacto.
Nesse aspecto ainda há outra questão, o fato de que quanto maior a afinidade entre as substâncias, maior será a velocidade da reação. Por exemplo, ao considerarmos as reações de oxidorredução, essa afinidade corresponde à tendência de ganhar elétrons que um dos reagentes tem e a tendência de perder elétrons do outro reagente. No caso dos metais, eles têm a tendência de doar elétrons, oxidando-se. Quanto maior for essa tendência, maior é a reatividade do metal. Abaixo é mostrada a fila de reatividade dos metais e do hidrogênio:

Observe que o ouro (Au) é o metal menos reativo. Esse é um dos principais motivos para que ele seja tão valioso. O ouro é bastante resistente à exposição ao oxigênio e à umidade do ar, bem como ao ataque de ácidos isolados, sendo atacado somente por água régia, que é uma mistura de três partes de ácido clorídrico com uma parte de ácido nítrico. É por isso que muitas peças de ouro, como os sarcófagos do Egito antigo, continuam em ótimas condições até hoje.

- Teoria das colisões: Para que uma reação química ocorra, as moléculas dos reagentes que entraram em contato devem colidir de modo efetivo. Abaixo é mostrado que nem sempre as colisões entre as moléculas são favoráveis, isto é, resultam na quebra de suas ligações dos reagentes e formação de novas substâncias (produtos):
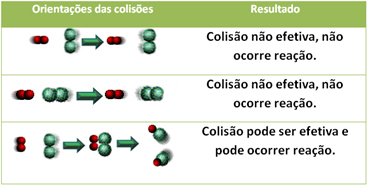
Quanto maior o número de colisões favoráveis, maior será a velocidade da reação química.
Entenda mais sobre esse aspecto no texto Teoria das colisões.
- Energia de ativação (Eat): Para que as colisões sejam favoráveis e resultem em reação química, é necessário que os reagentes possuam uma energia mínima, que é a energia de ativação.
A energia de ativação é necessária para a formação do complexo ativado, isto é, uma estrutura intermediária entre os reagentes e os produtos, onde as ligações dos reagentes estão sendo enfraquecidas e as ligações dos produtos estão sendo formadas:
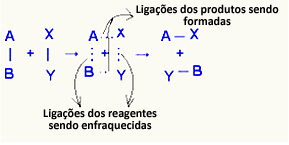
Sem a energia de ativação, a reação não acontece. Por exemplo, no caso do sódio com a água, esses reagentes possuem a energia mínima para que a reação entre eles ocorra, por isso, só por estarem em contato, eles já reagem.
Agora considere outro caso: o gás propano, presente no gás de cozinha, possui afinidade química com o oxigênio do ar para entrar em combustão. No entanto, tais reagentes não possuem a energia de ativação e é por isso que quando abrimos a válvula do fogareiro, deixando o gás escapar, não acontece reação nenhuma. É preciso fornecer energia para a reação de combustão ocorrer e é isso que é feito quando aproximamos o palito de fósforos. Visto que essa reação de combustão é exotérmica, liberando energia, a reação continua ocorrendo até que pelo menos um dos reagentes seja totalmente consumido.
Portanto, quanto menor for a energia de ativação, mais rápida será a velocidade com que a reação se desenvolverá. Sobre isso, leia o texto Energia de Ativação e Complexo Ativado.
* Crédito editorial da imagem: Autor: Tavoromann/ Fonte de onde foi extraída: Wikipédia Commons
Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















