Influência da Pressão no Deslocamento do Equilíbrio Químico

O princípio de Le Chatelier diz que alguma alteração no equilíbrio químico faz com que o equilíbrio seja deslocado no sentido de minimizar os efeitos causados pela perturbação.
Assim, se aumentarmos a pressão em sistemas gasosos, o equilíbrio irá se deslocar no sentido da reação capaz de diminuir essa pressão e vice-versa.
Para sabermos qual será então o sentido do deslocamento, precisamos analisar primeiro o número de mols de cada substância envolvida e relacionar com o volume. Por exemplo, consideremos a seguinte reação em equilíbrio químico:
1 PCl3(g) + 1 Cl2(g) ↔ 1 PCl5(g)
1 mol + 1 mol 1 mol
2 mol 1 mol
- 1 mol = 1 volume (1 V)
- 2 mol = 2 volumes (2 V)
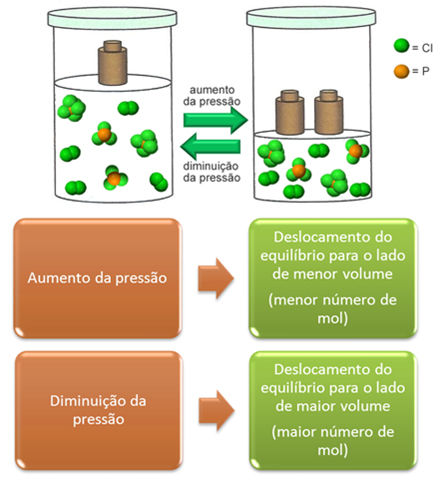
Se aumentarmos a pressão sobre esse sistema, o equilíbrio se deslocará no sentido direto, favorecendo a formação de PCl5(g), porque nesse sentido há uma diminuição do número de mol de gás, um menor volume e, em consequência, a pressão irá diminuir.
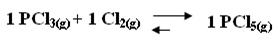
O contrário também é verdadeiro, a diminuição da pressão fará com que o equilíbrio se desloque para a esquerda, no sentido da reação inversa, porque nesse sentido há um aumento do número de mol e do volume, aumentando também a pressão.
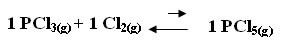
O esquema abaixo mostra bem como isso ocorre:
OBSERVAÇÕES IMPORTANTES:
- A variação da pressão não afeta as substâncias sólidas, porque elas são incompressíveis. Assim, um aumento da pressão em um equilíbrio que contém sólido irá deslocar o equilíbrio no sentido desses sólidos e não da substância gasosa.
- Se os volumes (números de mol) dos gases nos reagentes e nos produtos forem iguais, a variação da pressão não deslocará o equilíbrio.
- A adição de um gás inerte não afeta o equilíbrio químico de uma reação, apesar dele aumentar a pressão total do sistema. Isso ocorre porque ele não participa da reação e as concentrações e as pressões parciais dos gases participantes da reação não são alteradas.
Ferramentas Brasil Escola
Artigos Relacionados

Últimas notícias
Outras matérias