Entalpia de Neutralização


As reações de neutralização sempre ocorrem entre um ácido, que libera o cátion H+, e entre uma base, que libera o ânion OH-. Esse tipo de reação é sempre exotérmico, ou seja, libera energia, pois parte da energia dos íons é utilizada para formar as ligações, que formam as moléculas de água e a energia restante é liberada. Desse modo, o valor da entalpia de neutralização será sempre negativo.
O valor da variação de entalpia ou calor de neutralização (?Hneutralização) será sempre o mesmo para reações que ocorrerem entre ácidos e bases fortes. Abaixo temos alguns exemplos desse tipo de reação:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l) ?Hneutralização = -57,7 kJ ou 13,8 kcal
HBr(aq) + NaOH(aq) → NaBr(aq) + H2O(l) ?Hneutralização = -57,7 kJ ou 13,8 kcal
½ H2SO4(aq) + KOH(aq) → ½ K2SO4(aq) + H2O(l) ?Hneutralização = -57,7 kJ ou 13,8 kcal
Em todos esses casos a entalpia de neutralização tem o mesmo valor de -57,7 kJ, pois como são ácidos e bases fortes, a ionização dos ácidos e a dissociação das bases ocorre de forma completa. Isso significa que em meio aquoso eles fornecem 100 % de íons H+ e OH-. Assim, em todos os casos a formação da água se dará através da única reação responsável pela manifestação de calor, descrita abaixo:
H+(aq) + OH-(aq)→ H2O(l)
Observe como isso é verdade nos três casos:
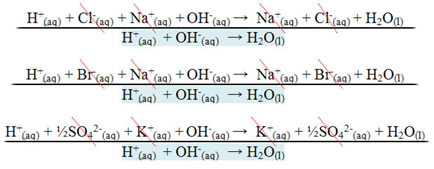
Assim, em todos esses casos, o diagrama ou gráfico que representa a entalpia de neutralização será o mesmo, mostrado a seguir:
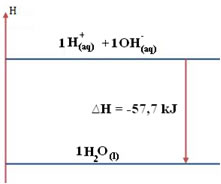
No entanto, se a reação de neutralização ocorre com a presença de uma base ou de um ácido fracos, o valor do calor liberado será menor do que o ?Hneutralização = -57,7 kJ. Isso ocorre porque parte da energia liberada é usada também para ionizar mais ácido (se o ácido for fraco), ou para dissociar mais base (se a base for fraca). Dessa forma, ocorrem duas reações, como no caso abaixo em que a base é forte, mas o ácido é fraco:

Ferramentas Brasil Escola

Artigos Relacionados

Últimas notícias
Outras matérias


















