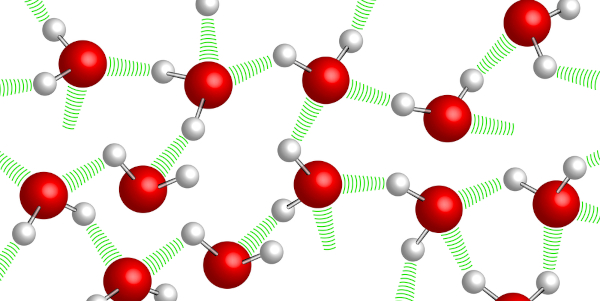
Forças intermoleculares
As forças intermoleculares são atrações temporárias que surgem devido à distribuição desigual de cargas elétricas na superfície das moléculas. Essa distribuição desigual cria regiões positivas e negativas temporárias, resultando em uma espécie de "polaridade instantânea". Por meio do conhecimento dessas forças, os cientistas podem projetar novos materiais, entender as propriedades dos solventes e solutos em soluções e até mesmo desenvolver medicamentos mais eficazes.
São exemplos de forças intermoleculares:
-
força de dipolo-dipolo;
-
forças de dispersão de London;
-
pontes de hidrogênio ou ligações de hidrogênio;
-
forças íon-dipolo.
Leia também: Ligações químicas — o que são e por que ocorrem?
Resumo sobre forças intermoleculares
-
As forças intermoleculares são mais fracas do que as forças intramoleculares, que mantêm os átomos unidos dentro de uma molécula.
-
Afetam propriedades físicas das substâncias, como ponto de ebulição, ponto de fusão, solubilidade, viscosidade e tensão superficial.
-
Os diferentes tipos de forças intermoleculares incluem forças de dipolo-dipolo, forças de dispersão de London e ligações de hidrogênio.
-
Forças de dipolo-dipolo ocorrem entre moléculas polares e resultam da atração entre os dipolos elétricos.
-
Forças de dispersão de London ocorrem mesmo em moléculas apolares e são causadas por flutuações momentâneas na distribuição eletrônica.
-
Ligações de hidrogênio são interações especiais em que um átomo de hidrogênio precisa estar ligado a um átomo de nitrogênio, oxigênio ou flúor.
-
Desempenham um papel importante nas propriedades físicas das substâncias e influenciam sua fase de matéria (sólido, líquido, gasoso) e outras características observáveis.
O que são forças intermoleculares?
As forças intermoleculares são forças de atração que atuam na interação entre moléculas vizinhas e, consequentemente, exercem alterações significativas no estado físico da matéria (sólido, líquido e gasoso), pois são elas que mantêm a agregação das partículas em diferentes condições de temperatura e pressão.
Ocorrem em moléculas neutras e influenciam diretamente nas características físico-químicas das substâncias, como ponto de fusão, ebulição, viscosidade, solubilidade e tensão superficial. Além disso, elas variam de acordo com a natureza das ligações intramoleculares de cada espécie química e suas respectivas polaridades.
Quais são os tipos de forças intermoleculares?
Essas forças ocorrem de acordo com o tipo de ligação intramolecular existente na molécula (covalente polar ou apolar), que, ao aproximar-se da molécula vizinha, gera uma resposta de atração devido à disposição dos elétrons em cada molécula. Sendo assim, podemos destacar os seguintes tipos de forças intermoleculares:
-
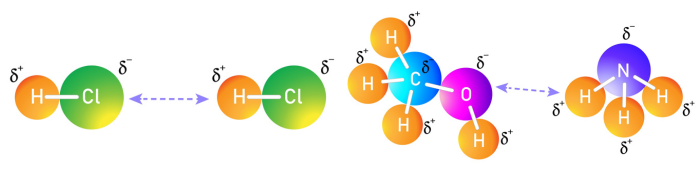
Força de dipolo-dipolo: também conhecida como força dipolo permanente, ocorre quando moléculas polares interagem entre si. Isso acontece devido à distribuição desigual de carga elétrica na molécula, gerando uma carga parcialmente positiva (polo positivo) e uma região parcialmente negativa (polo negativo). Os polos positivos de uma molécula atraem os polos negativos de outras moléculas, criando uma ligação de dipolo-dipolo. Para saber mais sobre esse tipo de força intermolecular, clique aqui.
-
Forças de dispersão de London: também conhecidas como forças de Van der Waals, essas forças ocorrem entre todas as moléculas, sejam elas polares, sejam apolares. Elas são causadas por flutuações momentâneas na distribuição eletrônica das moléculas, criando dipolos temporários. Esse efeito é chamado de polarizabilidade e pode ser compreendido quando se imagina uma nuvem eletrônica sendo “pressionada” pela aproximação de uma molécula com uma nuvem eletrônica de maior intensidade (maior peso molecular), pois isso faz com que os elétrons da molécula menor sejam repelidos para o lado oposto, fazendo com o que seu núcleo seja atraído pela nuvem eletrônica de maior intensidade, formando-se, dessa forma, polos momentâneos.
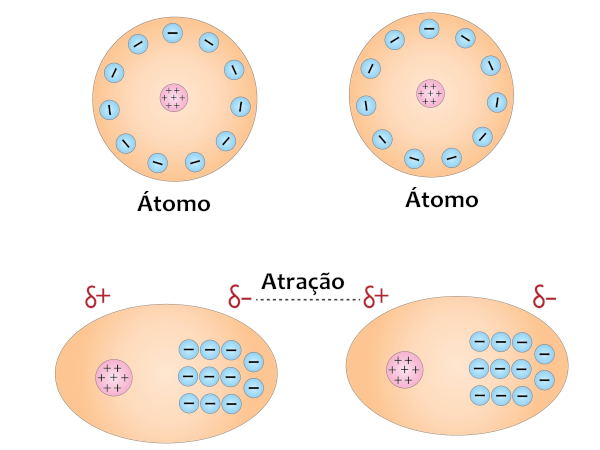
Esse tipo de atração pode ser visualizado principalmente em moléculas apolares, como é caso do CH4 e I2; CO2 e BH3; N2 e O2, ilustrados abaixo:
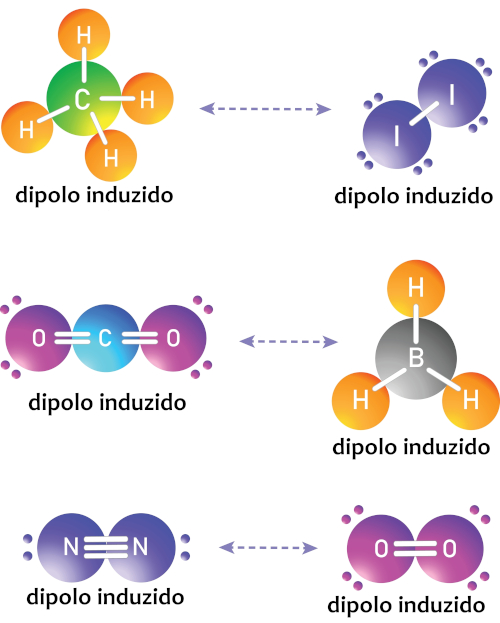
-
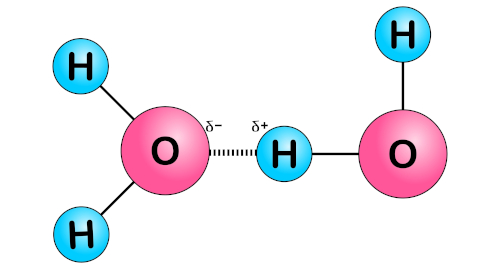
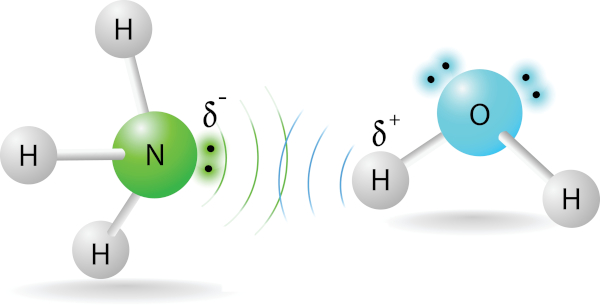
Pontes de hidrogênio ou ligações de hidrogênio: ocorrem somente quando um átomo de hidrogênio estiver ligado a um átomo de oxigênio (O), nitrogênio (N) ou flúor (F). É um caso particular de dipolo permanente, já que se trata de moléculas polares. Essa ligação é mais forte do que as forças de dipolo-dipolo e de dispersão de London, resultando em propriedades específicas, como altos pontos de ebulição e solubilidade em água. Para saber mais sobre esse tipo de força, clique aqui.
-
Forças íon-dipolo: são interações atrativas que ocorrem entre um íon e uma molécula polar adjacente. Essas forças surgem devido à atração eletrostática entre as cargas opostas do íon e do dipolo molecular. Quando um íon se aproxima de uma molécula polar, ocorre uma atração entre as cargas opostas. O íon positivo é atraído pela região negativa do dipolo molecular, enquanto o íon negativo é atraído pela região positiva. Essa atração eletrostática resulta nas forças íon-dipolo. Além disso, pode ocorrer de um íon induzir a polarização de uma molécula apolar, nesse caso teremos uma força íon-dipolo induzido. Esses exemplos podem ser mais bem visualizados na figura abaixo:
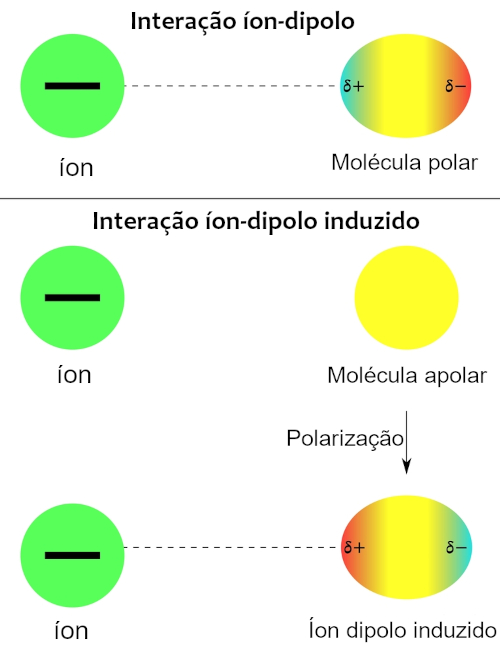
Diante disso, percebe-se que cada tipo de interação entre moléculas é regido por diferentes tipos de forças intermoleculares, em que cada uma apresenta certa magnitude, sendo a de dispersão de London a mais fraca e a de íon-dipolo a mais forte, como é mostrado na figura abaixo.

Forças intermoleculares e o ponto de ebulição
Quanto mais fortes forem as forças intermoleculares em uma substância, maior será a energia necessária para superá-las e, consequentemente, maior será o ponto de ebulição da substância.
Leia também: Características dos compostos iônicos
Forças intermoleculares x forças intramoleculares
As forças intermoleculares ocorrem numa magnitude e proporção diferentes das forças intramoleculares. Uma vez que intermoleculares, como já foi dito, são as forças que atuam entre moléculas vizinhas, as forças intramoleculares atuam no interior da molécula, ou seja, são as forças que mantêm os átomos da molécula unidos, caracterizando, assim, determinada substância. As principais diferenças entre elas são destacadas na tabela abaixo.
|
|
Forças intermoleculares |
Forças intramoleculares |
|
Escala de atuação |
Entre moléculas vizinhas |
Dentro da molécula |
|
Magnitude da força |
Mais fracas, pois determinam agregação das moléculas. |
Mais fortes, pois mantêm os átomos unidos para formar uma substância. |
|
Natureza |
Contribuem nas propriedades físicas das substâncias. |
Contribuem na estabilidade e reatividade química. |
Exercícios resolvidos sobre forças intermoleculares
Questão 1
As forças intermoleculares são caracterizadas por ocorrerem entre:
a) os átomos de uma mesma molécula.
b) moléculas vizinhas.
c) prótons e nêutrons.
d) elétrons de uma mesma molécula.
e) núcleo atômico e os elétrons de uma mesma molécula
Justificativa: Letra B. As forças intermoleculares atuam entre moléculas próximas, ou seja, vizinhas, pois são caracterizadas pela atração gerada devido a uma polaridade momentânea ou permanente entre as moléculas envolvidas.
Questão 1
São exemplos de forças intramoleculares:
a) dispersão de London.
b) ligações de hidrogênio.
c) dipolo-dipolo.
d) iônica, covalente e metálica.
e) íon-dipolo.
Justificativa: Letra D. Intramolecular (intra = dentro) significa dentro da molécula. Portanto, são as forças que formam as ligações químicas entre os átomos que compõem a molécula: iônica, covalente ou metálica.