Osmose nos seres vivos
A osmose é a passagem de solvente através de uma membrana semipermeável para uma solução mais concentrada (veja o texto Osmose- Uma Propriedade Coligativa). Esse fenômeno é espontâneo e o volume da solução que recebe o solvente vai crescendo até que sua altura exerça uma pressão sobre a membrana, impedindo o fluxo do solvente.
Essa pressão que evita a osmose é chamada de pressão osmótica, ela é simbolizada por π. Essa é uma propriedade coligativa, o que significa que não depende da natureza das partículas, mas sim da concentração da solução (A pressão osmótica é explicada em mais detalhes no texto Pressão Osmótica).
As membranas celulares dos vegetais, animais e do ser humano funcionam como uma membrana semipermeável. Abaixo, temos a ilustração de uma membrana plasmática de uma célula humana, composta por uma bicamada de fosfolipídeos, que funciona como uma membrana semipermeável, pois possui ação seletiva quanto ao tipo de substâncias que pode atravessá-la, controlando a saída e a entrada de moléculas e íons:
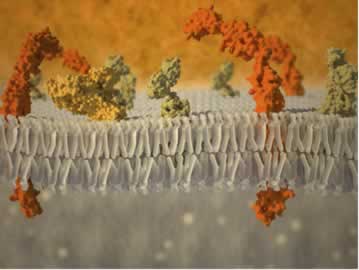
Portanto, o fenômeno da osmose ocorre nos seres vivos.
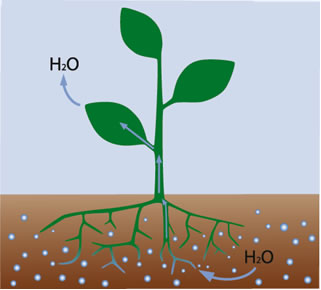
Outro exemplo é a ascensão da seiva nas plantas. As raízes das árvores funcionam como uma membrana semipermeável permitindo a passagem de água, ureia e outras substâncias, mas impedindo a passagem de íons sódio, glicose e outros. Como a solução que está dentro da raiz da planta é mais concentrada que a da terra, ocorre a passagem de água pela raiz para dentro da planta.
Para que essa água suba e atinja todas as regiões da planta, a pressão osmótica pode atingir valores de 50 atm.
O nosso sangue apresenta uma pressão osmótica de cerca de 7,8 atm, sendo que as hemácias ou glóbulos vermelhos também. Isso permite a passagem fácil de moléculas de água para dentro e para fora das hemácias. É por isso que o soro fisiológico e as injeções intravenosas devem possuir a mesma pressão do sangue. Dessa forma, dizemos que o soro e os glóbulos vermelhos são isotônicos. Veja também o texto sobre os Isotônicos.
Mas, se a pressão osmótica for diferente, isso afetará gravemente as hemácias. Por exemplo, se o soro for mais diluído, haverá osmose ou a passagem de água para dentro da hemácia, fazendo com que ela inche e possa até estourar. Nesse caso, dizemos que o meio é hipotônico.
Já se ocorrer o contrário, se o soro estiver mais concentrado, a hemácia perderá água para o meio externo, murchando. Temos, então, um meio hipertônico.
.jpg)
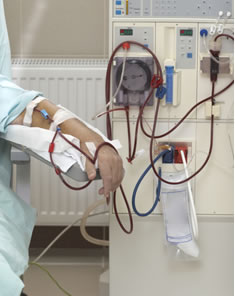
A hemodiálise também se baseia nesse mesmo princípio da osmose, com a única diferença de que não ocorre a passagem somente do solvente pela membrana, mas também as partículas do soluto (entre elas, os resíduos tóxicos produzidos em nosso organismo).
O sangue da pessoa é bombeado para um tubo revestido de uma membrana semipermeável, imerso em uma solução com componentes do plasma sanguíneo. As partículas dos resíduos tóxicos presentes no sangue da pessoa passam através da membrana (processo de osmose), sendo eliminados. Já o sangue limpo volta para o corpo do paciente. Como as células sanguíneas, as proteínas e outros componentes são grandes, eles não passam pelos poros da membrana.